小胶质细胞研究前线~从基础到临床~
![]()
九州大学大学院药学研究院生活创新领域 津田诚
“小胶质细胞研究前线~从基础到临床~”系列的寄语
在发现小胶质细胞100周年之际,Wako举办了第35届Wako研讨会“小胶质细胞研究前线~从基础到临床~”(2019年11月)。此次作为和光纯药时报的系列文章,获得了连载“小胶质细胞研究前线”的好机会。神经胶质(glia;英文为glue),顾名思义神经胶质过去曾被认为是填充神经和神经之间间隙的胶状物质(neuroglia),但从最近的基础研究中,不断表明神经胶质是对神经活动有很大影响力的重要细胞。尤其是在现代医疗中,已明确了小胶质细胞在仍然难以克服的神经系统疾病中具有重要作用。因此以小胶质细胞为起点阐明疾病的机制并开发诊断和治疗方法的期望不断增高。在本系列中将邀请日本多位专业资深的老师来给我们分享有关在神经系统疾病,例如阿尔茨海默氏病、癫痫、脑梗塞、精神疾病、慢性疼痛等中有重要作用的小胶质细胞的新知识以及展望。敬请期待。
◆前言
在对生物体施加有害刺激时,我们会利用痛觉系统产生疼痛并采取适当的防御措施。但是,晚期癌症或糖尿病、脑梗塞、脊髓损伤和带状疱疹治愈后,神经系统受损或受压迫引发功能障碍的话,就会发生被称为神经性疼痛的慢性疼痛。症状为自发性疼痛、痛觉过敏以及触觉刺激等一般不会引起疼痛的刺激引起的异常性疼痛。这些疼痛并不是单纯作为生物防御而不断产生的痛觉信号,比如像异常性疼痛那样的感觉方式本身发生了变化的症状,可能是由于体感信息传达系统的功能被破坏了。但是,在周围组织→初级传入神经→脊髓背角→大脑有关的神经传递系统中究竟是怎样的结构引起异常,其机制尚未阐明。在本文中,主要介绍小胶质细胞在脊髓和大脑中产生的痛觉传达异常中发挥的重要作用,并介绍由此产生的神经性疼痛机制以及今后的展望。
◆小胶质细胞
小胶质细胞是组成中枢神经系统的神经胶质细胞之一。成熟小胶质细胞存在于具有多个细小分支突起的小细胞体中(图1)。大脑小胶质细胞的生物成像分析表明,小胶质细胞经常活动其突起,以应答突触活动和细胞损伤等,在时空上拥有非常动态的活动性1)。从2010年以后开始的fate-mapping研究认为,小胶质细胞起源自存在于胚胎卵黄囊中的祖细胞,并通过血流移动至大脑并分化、成熟形成小胶质细胞2)。现在,小胶质细胞被分类为中枢神经系统的组织驻留巨噬细胞。为了维持成熟的小胶质细胞,自我更新的理论替代了以往的骨髓细胞供给理论。虽然详细情况还没有被阐明,但在细胞集落刺激因子1受体(CSF1R)缺失3)、抑制剂治疗4)和白介素-34(IL-34)缺乏5)时,小胶质细胞数量会减少或消失,由此可以看出,这些都是维持的重要信号。
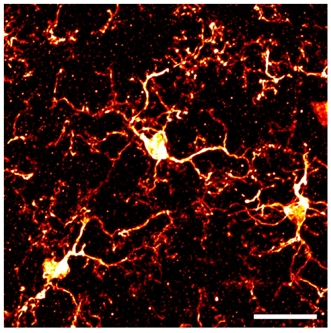
图1. 正常状态的小胶质细胞(脊髓背角)
IBA1抗体免疫组织染色图像。比例尺:50 μm
◆脊髓背角小胶质细胞
在神经性疼痛的基础研究中,使用了周围神经直接损伤(主要是坐骨神经和腰椎神经)的动物模型。在1970年代,报道了由于切断坐骨神经从而激活了脊髓背角的小胶质细胞,之后在1990年代提出了神经性疼痛与小胶质细胞间的相关性,而在2003年首次明确了两者间的因果关系6)。此后,小胶质细胞作为神经性疼痛机制被全世界关注,至今为止小胶质细胞的研究仍然十分活跃。下文将概述至今为止已经阐明的分子细胞机制。
<小胶质细胞的激活机制>
由于周围神经损伤,脊髓背角的小胶质细胞显示出如细胞体肥大、突起收缩以及细胞数量急剧增加等剧烈的细胞应答7)。细胞数的增加与小胶质细胞自身的细胞分裂引起的自我增殖相关。其分子机制是在受损神经中,具有双亮氨酸拉链激酶(DLK)依赖性的CSF1表达增强,通过神经轴突转运至脊髓背角,作用于小胶质细胞的CSF1R,这一假设比较有说服力8,9)(图2)。另一方面,在与血脑屏障破坏相关的疾病模型的脑和脊髓中,观察到了外周血来源的单核细胞/巨噬细胞的浸润。在神经性疼痛模型中,虽然神经损伤后血液脊髓屏障的功能会暂时降低,但是未观察到外周血来源单核细胞在脊髓背角内的浸润10)。
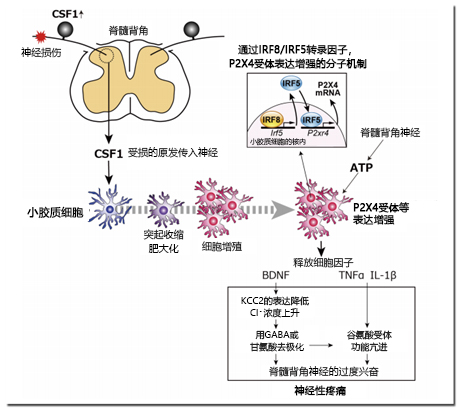
图2. 脊髓背角的小胶质细胞激活和神经功能调节机制
受损后的原发传入神经表达的CSF1增强,与脊髓背角的小胶质细胞的CSF1受体作用,并伴随形态变化、细胞增殖和基因表达被激活。P2X4受体通过IRF8-IRF5转录因子级联表达增强。脊髓背角中间神经元释放的ATP刺激P2X4受体,从小胶质细胞释放体液因子。BDNF通过KCC2的表达降低来提高细胞内Cl– 的浓度,并将GABA和甘氨酸的作用转化为兴奋性。其神经兴奋,TNFα和IL-1β亢进了谷氨酸受体的功能,引起脊髓背角神经的过度兴奋,导致神经性疼痛。
<通过激活小胶质细胞的感觉传递调节机制>
激活的小胶质细胞在表观基因组水平上发生变化11),并通过细胞膜受体、细胞内磷酸酶和体液因子等各种基因表达功能性激活6)。作为代表性的分子,例如ATP等的细胞外核苷酸的受体(P2受体)。神经损伤后的脊髓中,离子通道型的P2X4和P2X7受体以及G蛋白偶联的P2Y12受体的表达主要在小胶质细胞中特异性增加,并且其功能和表达的阻碍明显抑制了了异常性疼痛6,12)。P2X4受体的表达增强是由于转录因子IRF8和IRF5的诱导13,14)。同受体被从脊髓背角中间神经元释放的ATP激活15),产生并释放大脑来源神经营养因子(BDNF)等的体液因子。这使向大脑传达疼痛信息的脊髓背角神经KCC2的表达降低,扰乱细胞内外的Cl-浓度梯度。将GABA和甘氨酸的作用转为兴奋性16),这还导致NMDA受体的激活,最终引起同一神经的异常兴奋(图2)6)。
小胶质细胞是大脑和脊髓中炎性细胞因子的主要产生细胞。IL-1β通过TREM2 / DAP12、toll样受体(TLR)和NLRP3炎症小体产生,亢进了脊髓背角神经中谷氨酸受体功能,并抑制了GABA受体和甘氨酸受体功能6)。TNFα在小胶质细胞中选择性表达,除了直接作用于脊髓背角神经外,还通过间接作用于星形胶质细胞和血管内皮细胞提高神经的兴奋性。此外,TNFα作用于小胶质细胞来提高BDNF的表达,增加疼痛传递神经的脊柱结构和突触连接17)。另外,小胶质细胞释放的血小板激活因子(PAF)形成刺激自分泌小胶质细胞的PAF受体并诱导PAF产生的正循环,与神经性疼痛相关18)。
◆大脑小胶质细胞
尽管与脊髓背角的小胶质细胞相比,形态变化并不大,但是周围神经损伤时在多个大脑部位被激活。在支配奖赏系统的腹侧被盖区激活的小胶质细胞与中脑边缘系统多巴胺能和奖赏系统的降低相关19)。海马小胶质细胞与CA1金字塔型脊柱密度、突触传递、BDNF表达水平以及记忆力降低有关17)。另一方面,在中央杏仁核中,外周血来源单核细胞/巨噬细胞在相对较晚的时期(神经损伤后4周)浸润,这与NMDA受体的磷酸化和焦虑行为有关20)。因此,笔者认为大脑中激活的小胶质细胞与神经性疼痛的情绪和记忆等相关。
◆治疗和诊断的发展
包含P2X4受体在内,已开发了多种靶向小胶质细胞表达分子的化合物和抗体,其有效性都在非临床测试中有报告6,21)。笔者期望它的有效性能在以神经性疼痛患者为对象的临床测试中显示出来。
人脑和脊髓中的小胶质细胞成像技术可以应用于药物发现、治疗和诊断。尽管小胶质细胞的活检非常困难,但是九州大学的加藤隆弘等人的研究小组发现,在纤维肌痛患者外周血中,从单核细胞分化出的小胶质细胞样细胞(iMG细胞)中发现了TNFα释放能高,这与疼痛相关22)。期望未来进一步的研究中,iMG可以应用于慢性疼痛的诊断和治疗。
◆结语
根据至今十几年间积累的大量研究结果表明,神经性疼痛的病发不仅是神经,也与伴随神经受损的脊髓背角和大脑激活的小胶质细胞有重要关系6)。另外,还有报告显示星形胶质细胞也参与神经性疼痛(请参考其他总论23))。迄今为止,神经胶质细胞一直被认为是仅支持神经的细胞,但这些研究表明,神经胶质细胞的活动对神经功能有极大的影响。根据神经性疼痛机制和中枢神经功能来看,神经和神经胶质间相互作用的观点很重要。另一方面,最近细胞分析显示的小胶质细胞的异质性在神经受损后如何崩溃,以及它对慢性疼痛拥有什么意义是完全未知的,这将是今后一个重要的课题。未来,通过阐明小胶质细胞亚群的作用以及与神经的相互作用,笔者相信可以开辟一条阐明神经性疼痛机制和开发治疗药物的重要途径。
◆参考文献
1)Wake, H. et al. : Trends Neurosci., 36, 209 (2013).
2)Prinz, M. et al. : Cell, 179, 292 (2019).
3)Erblich, B. et al . : PLoS One , 6, e26317 (2011).
4)Elmore, M. R. et al. : Neuron, 82, 380 (2014).
5)Wang, Y. et al . : Nat. Immunol., 13, 753 (2012).
6)Inoue, K. and Tsuda, M. : Nat. Rev. Neurosci., 19, 138 (2018).
7)Kohno, K. et al. : Biol. Pharm. Bull., 41, 1096 (2018).
8)Guan, Z. et al. : Nat. Neurosci., 19, 94 (2016).
9)Wlaschin, J. J. et al. : Elife, 7, (2018).
10)Tashima, R. et al. : Sci. Rep., 6, 23701 (2016).
11)Denk, F. et al. : Cell Rep., 15, 1771 (2016).
12)Tsuda, M. et al. : Nature, 424, 778 (2003).
13)Masuda, T. et al. : Cell Rep., 1, 334 (2012).
14)Masuda, T. et al. : Nat. Commun., 5, 3771 (2014).
15)Masuda, T. et al. : Nat. Commun., 7, 12529 (2016).
16)Coull, J. A. et al. : Nature, 438, 1017 (2005).
17)Liu, Y. et al. : J. Neurosci., 37, 871 (2017).
18)Shindou, H. et al. : Faseb J., 31, 2973 (2017).
19)Taylor, A. M. et al. : J. Neurosci., 35, 8442 (2015).
20)Sawada, A. et al. : Pain, 155, 1762 (2014).
21)Williams, W. A. et al. : Pain, 160, 1989 (2019).
22)Ohgidani, M. et al . : Sci. Rep., 7, 11882 (2017).
23)Ji, R. R. et al. : Nat. Rev. Neurosci., 20, 667 (2019).
◆产品列表
产品编号 | 产品名称 | 规格 | 包装 |
Anti Iba1, Rabbit (for Immunocytochemistry) | 免疫化学用 | 50 μg |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |