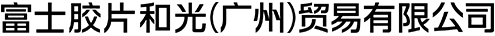组织透明化试剂
大脑的三维观察作为了解复杂神经网络的方法备受关注。传统方法需要拍摄和重建连续切片,不仅需要花费大量的精力与时间制备和叠加切片,还会破坏组织形态。在此背景下,组织透明化技术作为大脑三维观察的新策略备受瞩目。该技术迄今已有100多年的历史,但其性能仍在不断提高,近年来已逐步成为大脑三维观察的强力技术。FUJIFILM Wako可提供多种透明化技术相关试剂,可根据观察目的选择合适的透明化试剂。
点击此处下载组织透明化研究专题宣传PDF |
◆透明化原理
“减少光散射“是组织透明化技术的关键。通常,生物组织与溶剂(浸泡生物组织的液体)的折射率不同,这种折射率的差异会导致光散射。因此,去除生物组织中的高折射率成分或更换高折射率的溶剂可使折射率均一,从而实现组织透明化。
过去也曾基于该原理开发过透明化技术,但这些技术存在使荧光蛋白变性等问题。因此,使用这些透明化技术进行分析时需要结合多种染色方法。与此同时,显微镜和荧光蛋白等与成像相关的技术也有了显著发展,组织三维分析所需的技术基础也在不断完善。在此背景下,近年为配合新型荧光显微镜技术和荧光蛋白的使用而优化的透明化技术得到了蓬勃发展,从而实现了组织深部的三维分析。
◆透明化技术
传统透明化技术中常使用有机溶剂,但在发光过程中,需要水分子的荧光蛋白在此条件下会明显褪色。针对该问题,研究者开发了使用水溶液的透明化技术Scale法 (ScaleA2法和ScaleS法的总称)1)2)。Scale法使用尿素、表面活性剂、甘油(ScaleA2 法)或山梨醇(ScaleS 法)的混合溶液来抑制光散射,从而实现组织透明化的同时使荧光蛋白不褪色。此外,需要脱脂的表面活性剂含量少,因此,进行透明化后也可保持良好的超微结构。初次尝试组织透明化时,推荐使用这种能较好平衡透明度和结构保持的Scale法。
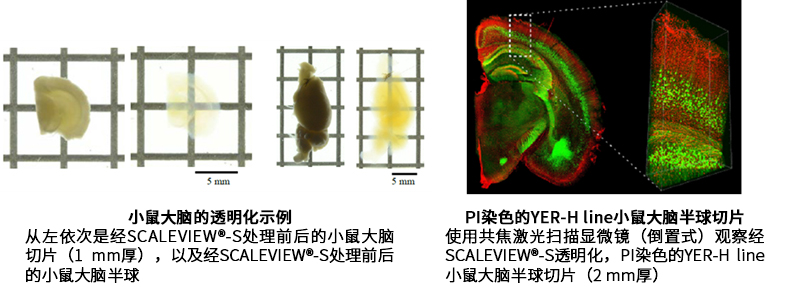
数据提供:国立研究开发法人理化学研究所 脑神经科学研究中心细胞机能探索技术研究小组/光量子工学研究中心生命光学技术研究小组 濱裕老师、星田哲志老师、宮脇敦史老师
赞助:奥林巴斯株式会社
若希望比Scale法更精细地观察深部,需要进一步提高透明度。CUBIC是通过重新改良ScaleA2法中使用的3种试剂(尿素、甘油和表面活性剂)而开发的透明化技术3)。通过使用氨基醇代替甘油,可实现比Scale法更高的透明度。此外,溶液中的氨基醇可去除组织中主要的吸光物质血红素,因此,CUBIC法也是透明化含血液器官的有效方法4)。CUBIC法有第1代和第2代,与第2代CUBIC相比,第1代 CUBIC 具有以下的特点:① 透明化过程可见;②样品易于处理。因此,推荐想尝试透明化的初学者使用。此外,与第1代CUBIC相比,第2代的透明度更高,透明化所需的时间更短。

数据提供:国立研究开发法人理化学研究所 洲﨑悦生老师、上田泰己老师
使用CUBIC法和CLARITY法(见下文)进行透明化时,生物组织的大小会短暂地发生改变,导致微组织形态受损。SeeDB2法通过将生物组织浸泡在含有皂苷的碘海醇溶液中,在保持超微结构的同时实现组织透明化,从而解决上述问题5)。由于使用高折射率的溶液,尽可能地抑制折射率差造成的影响,因此可以进行更深入的成像。溶液中不含表面活性剂,虽然透明度不如其他方法,但其具有优异的组织结构保持能力,可通过共聚焦显微镜和超分辨率显微镜观察树突棘形态。并且,SeeDB2法使用的溶液对荧光蛋白的稳定性高,适用于抑制褪色。但需要注意DAPI和Alexa等染料容易发生光褪色。
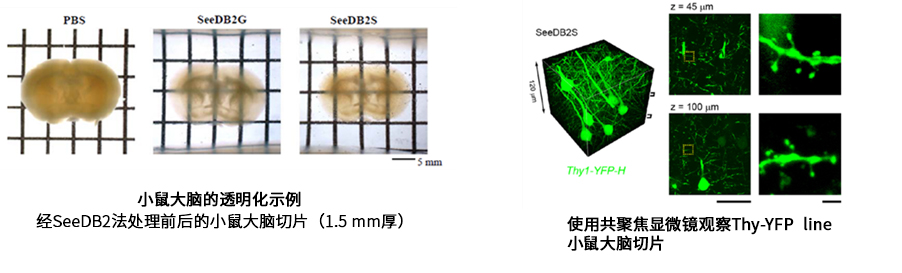
数据提供:国立大学法人 九州大学医学研究院 坂口理智老师、今井猛老师
国立研究开发法人理化学研究所 柯孟岑老师
大脑组织透明化的难点在于去除大量存在于髓鞘等的脂质。CLARITY法将脑蛋白与聚丙烯酰胺聚合交联后,在含SDS的缓冲液中通过电泳去除脂质6)。虽然操作比其他方法复杂且透明化需要约1周的时间,但它可有效去除细胞膜成分,物质渗透性好,适合用于抗体染色。
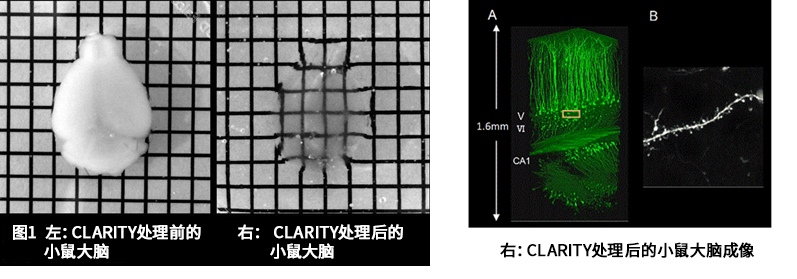
数据来源:Chung, K et al. : Nature., 497, 332 (2013).
◆ 如何选择透明化技术
在进行透明化组织的三维荧光成像时,根据实验目的选择合适的透明化技术非常重要,了解每种技术的特点有助于选择合适的透明化技术。
进行全脑成像时,推荐选择简便且重复性高的CUBIC法。CLARITY法可有效应对CUBIC法透明化时出现的样品脆弱和透明度不足的问题。但是,CLARITY法和CUBIC法均无法避免样品的膨润问题。此外,使用这两种方法进行全脑成像十分耗时,且无法使用常规的共聚焦显微镜进行高分辨率成像。另一方面,使用超分辨显微镜和光片显微镜可实现快速成像,但在观察高折射率透明化样品时的分辨率不足。并且,CUBIC法和CLARITY法在透明化过程中样品会发生膨润,不一定能保持微结构。因此,相比观察微结构,这两种方法更适用于细胞水平和轴突束水平的成像。
定量分析各轴突或树突(0.5-数μm)时,推荐使用透明化过程中不会引起样品膨润或收缩的SeeDB2法。使用SeeDB2法进行观察时,相比光片显微镜,更推荐使用共聚焦或双光子激发显微镜。但是,深度超过3,4 mm时,则难以观察到单一的轴突,因此,需要制备合适的大脑切片,并对神经元进行稀疏标记。此外,观察树突棘等精细的结构(0.2-1 μm)时,推荐使用单光子激发共聚焦显微镜,而非双光子激发显微镜。但是,使用共聚焦显微进行高分辨率成像时不得不牺牲深度,因此推荐使用脑切片进行观察。
Scale法的透明度和组织结构保持能力居于CUBIC法和SeeDB2法之间。因此,当无需使用SeeDB2法进行微结构观察时,或尝试进行透明化实验时,可考虑使用Scale法。此外,使用Scale法也可轻松实现类器官和球状体的透明化。
另外,还可根据实验目的选用其他的透明化技术,如使用CUBIC法透明化小鼠全身和甲壳类动物,以及植物的透明化方法ClearSee™等。
观察对象 | 全脑 骨骼※ 类器官·球状体 | 全脑 大脑以外的组织骨骼※ | 大脑切片 类器官·球状体 | 全脑 大脑以外的组织骨骼※ | 植物组织 |
结构保持能力 | 高 | 暂时性膨润 | 非常高(不伸缩) | 暂时性膨润 | 高 |
可使用的染料 | 荧光蛋白 荧光染料 | 荧光蛋白 荧光染料 | 荧光蛋白 荧光染料(小心褪色) | 荧光蛋白 荧光染料 | 荧光蛋白 荧光染料 |
操作复杂性 | 非常简便 | 非常简便 | 简便 | 非常复杂 | 简便 |
操作时间 | 约1天 (2 mm厚 脑切片) | 第1代CUBIC: 10~15天 第2代CUBIC: 6天 (小鼠全脑) | 约3天 (2 mm厚 大脑切片) | 约1周 (2 mm厚 大脑切片) | 1-2天(根) 4-7天(叶子/幼苗) 2周(雌蕊) 4周(成熟组织) |
观察时折射率 | RI=1.47(SCALEVIEW-S4) RI=1.49(SCALEVIEW-SMt) | RI=1.49 | RI=1.46(SeeDB2G) RI=1.52(SeeDB2S) | RI=1.45 | RI=1.41 |
显微镜使用例 | 共聚焦/双光子显微镜 | 光片显微镜 | 电子/超分辨率显微镜 | 光片显微镜 | 共聚焦/双光子显微镜 |
※骨骼的透明化需要进行脱钙处理。
参考文献
1)Hama, H. et al. : Nature Neuroscience, 14, 1481 (2011).
2)Hama, H. et al. : Nature Neuroscience, 18, 1518 (2015).
3)E. A. Susaki. et al. : Cell, 157(3), 726 (2014).
4)K. Tainaka. et al. : Cell, 159(4), 911 (2014).
5)Ke, et al. : Cell Reports, 14, 2718 (2016).
6)Chung, K. et al. : Nature, 497, 332 (2013).
7)今井猛 : 生化学、87(2), 225 (2015).
◆产品应用/技术文章
标题 | 文章链接 |
第一回 透明化技术Scale 的介绍和应用 | |
第二回 高分辨率/高亮度荧光成像用透明化方法SeeDB2 | |
第三回 利用CUBIC实现组织透明化与3D观察 | |
第四回 被骨组织包围的内耳成像用透明化方法——Modified ScaleS | |
| 【技术文章】植物透明化试剂ClearSee的实际应用和改良 | 文章 |