![]()
九州大学大学院医学研究院 今井 猛
◆前言
近年来,虽然开发了各种激光显微镜,但还很难实现活组织图像的三维捕获。由于活组织会使光发生散射以及吸收,所以组织内部越是深入,观察就越困难。近年,为了克服以上问题,将活组织固定后进行透明化的方法已引起了广泛关注1),2)。所有的组织透明化方法都是通过减少光的散射和吸收来实现对组织内部的观察。现在,组织和器官的整体三维成像也变得更容易了。
大部分的读者可能都会认为透明化是观察大型组织和器官的方法。虽说这样认为也没有错,但是透明化方法在“高分辨率”成像中也是非常有用的工具。因此,本文将对通过透明化获得“高分辨率”的三维荧光图像的基础知识以及Wako开发的SeeDB2进行介绍。
◆光学显微镜的分辨率和数值孔径(NA),球面像差
首先,在考虑使用高分辨率成像时就必须先对显微镜的分辨率进行说明。对于共聚焦显微镜等激光荧光显微镜,其水平方向的分辨率d,可根据以下的瑞利公式计算得出。
d=0.61λ/NA
该公式中,λ指光的波长,NA指物镜的数值孔径(Numerical Aperture)。通过该公式可知,如果要减小d的值,就要增大NA的值。在荧光成像中决定分辨率的不是倍率而是NA,NA值定义为NA=n sinα。其中,n为浸液的折射率,α为1/2孔径角的值。因此具有高数值孔径的物镜大部分都不是使用干透镜,而是设计成使用高折射率的浸液,也就是油(折射率1.52)或甘油(折射率1.45-1.46)。因此可以实现200 nm左右的分辨率。NA值越大不仅分辨率更好,进入物镜的光量也越多,获得的图像也更清晰。由于亮度与NA值的平方成正比,所以 NA1.4的油浸镜头的亮度是NA1.0的水浸镜头的2倍。
如果想要清晰地观察细微构造的话,使用NA值大的物镜会比较有效。另外还存在使用不当导致成像模糊且容易昏暗的问题。使用油浸镜头观察“标本的表面”时,由于到焦点位置存在折射率为1.52的浸液和盖玻片,所以光会直射,荧光信号也会直射回来。因而想要观察稍微深入的地方时就会产生很大的问题。标本的折射率大部分介于水的1.33和甘油封固剂的1.46之间(图1A)。这时,由于折射率的差异,盖玻片和标本之间的界面会产生折射,原本聚焦到一点的激发光就会扩散,造成图像模糊。球面像差引起的模糊,水平方向(x-y)比轴方向(z)更明显。另外,荧光信号返回物镜时也会发生折射,通过针孔返回检测器的光量减少,结果导致图像变暗。如果这样由于标本的折射率不一致引起“球面像差”的话,图像就会模糊且变暗。因为在标本内部球面像差会变大,所以使用传统的高NA镜头观察标本深层是十分困难的。
◆利用SeeDB2进行高分辨率、高亮度成像
为了最小化球面像差,实现用高NA镜头进行深层观察,Wako开发了新的透明化试剂SeeDB23)。SeeDB2使用油浸镜头(使用SeeDB2S,折射率1.52)或甘油浸镜头(使用SeeDB2G,折射率1.45-1.46),可以使浸液和折射率达成一致,将球面像差降至最小(图1B)。因此,不仅可以保证在深层分辨率的恒定(图2A),还可以保持亮度(图2B)。另外,SeeDB2与传统的透明化试剂不同,不会使标本伸缩,可以高度维持细微的形态。由此可以看出,SeeDB2是适于高分辨率地观察细微形态标本的试剂。SeeDB2不仅可以观察大型器官和组织,还可在高分辨率地观察昆虫等较小的组织或培养细胞时发挥巨大的作用。SeeDB2的实验步骤除了在Wako的官网SeeDB Resources中查看外4),在bio-protocol杂志中也刊载了详细的实验步骤5)。制备完成的SeeDB2已上市销售。使用SeeDB2S(折射率 1.52)作为观察用封固剂时,可以直接使用市售的Super Clear Mount。
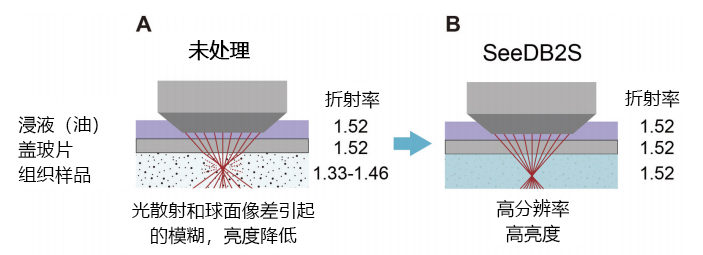
图1. 使用SeeDB2高分辨率成像的原理3)
在要求高分辨率的实验中,可有效使用甘油(NA 1.3 以上)或油浸(NA 1.4以上)的镜头。然而,传统的封固剂没有优化折射率,在标本深层会产生球面像差,无法获得预期的分辨率(A)。通过使用SeeDB2使标本的折射率与浸液一致,抑制球面像差,可以获得高分辨率和高亮度的图像(B)。
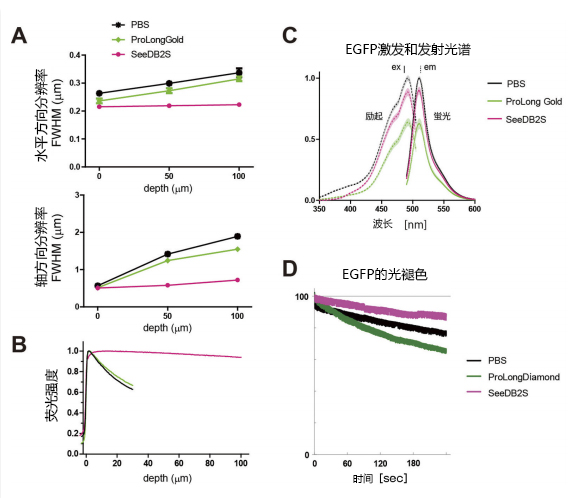
图2. 使用SeeDB2高分辨率,高亮度成像(A-C转载自文献3)
(A) 水平方向(x-y)以及轴方向(z)的分辨率(FWHM)。使用SeeDB2的话,即使是标本深层分辨率也十分稳定。
(B) 降低球面像差后,在深层也可以进行高亮度观察。此图是利用共聚焦显微镜(使用油浸镜头)观察罗丹明溶液,并测定其亮度。
(B)使用SeeDB2可以直至深部都获得相对稳定的亮度。
(C) 与一般市售的封固剂相比,SeeDB2几乎不会淬灭荧光蛋白的荧光强度。
(D) 与市售的荧光蛋白用的封固剂相比,SeeDB2还能抑制荧光蛋白的光褪色。
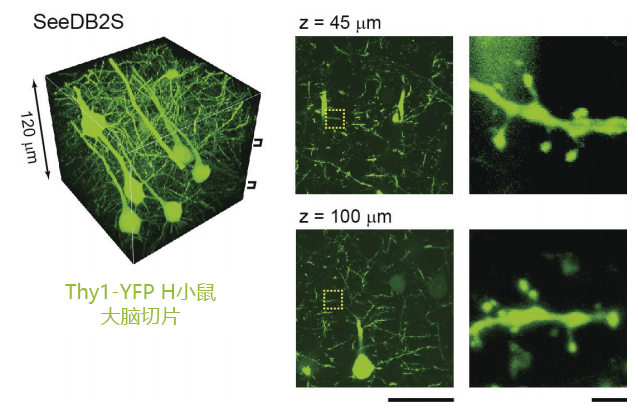
图3. 使用共聚焦显微镜进行深层观察(转载自文献3)
用SeeDB2处理Thy1-YFP H line小鼠大脑切片,使用NA 1.4的油浸镜头进行共聚焦显微镜观察。在切片浅的部分和深的部分获得了几乎稳定的分辨率。另外,无需更改激光功率也能获得稳定的亮度。图右显示的是树突棘。比例尺:左侧50 μm,右侧2 μm。
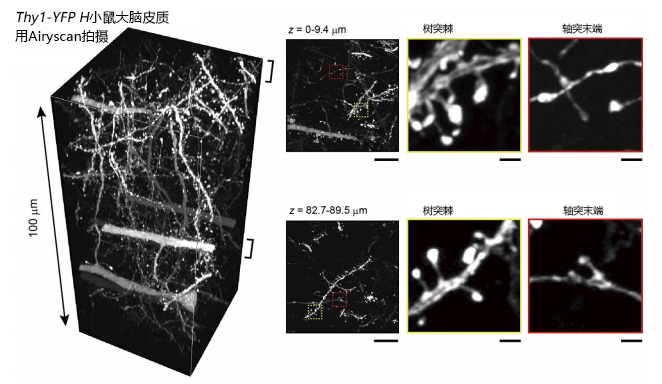
图4. 使用Airyscan(Zeiss 公司)观察大脑切片的案例(转载自文献3)
比例尺:左侧为10 μm,中间和右侧为1 μm。视频可在YouTube查看(https://youtu.be/TakrFLY7pU4)。
不仅是分辨率,荧光蛋白的稳定性也是SeeDB2S / Super Clear Mount一个显著的优点。鲜为人知的是市售的封闭剂从稳定性的角度出发,只优化了荧光素、罗丹明和Alexa染料等合成色素的使用,但荧光蛋白的稳定性不一定很好。实际上,广泛使用的甘油系的封固剂在封固荧光蛋白标本时,EGFP 或 EYFP的荧光会减少3-7成3)。另外,传统市售的封固剂中荧光蛋白的光褪色也很严重。与之相对的,使用SeeDB2S / Super Clear Mount的话,任何荧光蛋白的荧光强度都几乎不会变化,也极少引起光褪色(图2C,D)。由此可见,SeeDB2S / Super Clear Mount适于观察荧光蛋白。另外,与之相比,使用了市售的封固剂,DAPI和Alexa染料易于发生光褪色。
◆在共聚焦显微镜和超高分辨率显微镜中的应用
SeeDB2有效应用案例之一是神经细胞突触的定量分析。在大部分的神经细胞中,兴奋性突触输入仅限于称为树突棘的微突。树突棘除了会伴随突触的可塑性变化以外,其密度和形态的异常与精神疾病相关。因此,研究人员们广泛地使用双光子激发显微镜或共聚焦显微镜定量分析树突棘,然而,树突棘头部的直径极小,只有0.1-1 μm左右,想要正确地定量并不容易。使用Wako开发的SeeDB2S的话,利用共聚焦显微镜和油浸镜头直达标本深层可以获得高分辨率的图像。高NA物镜的工作距离为100-300 μm左右,如果标本在其范围内就可以获得高分辨率的图像(图3)。不仅是共聚焦显微镜,超高分辨率显微镜也可用于深层观察。STED显微镜(分辨率约50 nm)或Airyscan(分辨率约120-150 nm,图4)也可以高分辨地观察深度约100 μm左右的标本。在分析神经突起时,不仅是x-y方向的分辨率,z轴方向的分辨率也十分重要。使用SeeDB2,与传统法相比,z轴的分辨率得到了极大地改善,对神经突起的追踪和树突棘的定量分析十分有效。
SeeDB2S / Super Clear Mount不仅可以用于厚的标本,对于培养细胞等的超高分辨率成像的封固也是十分有效的。图5是用SR-SIM拍摄HEK293细胞的画像,通过减少球面像差,可以更清晰地观察到膜和细胞器的结构。
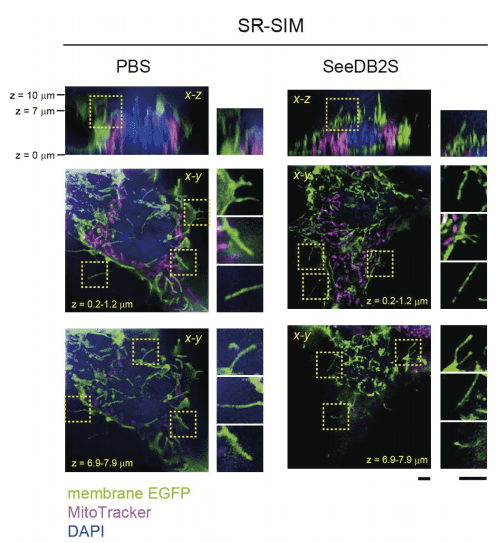
图5. 使用SR-SIM(Zeiss公司)对培养细胞(HEK293细胞)的超高分辨率成像案例(转载自文献3)。
比例尺为2 μm。
◆使用Tetbow对神经细胞进行多色标记
在荧光成像中,利用透明化试剂制备样品十分重要,并且样品的标记也很重要。如果观察对象没有高亮度染色的话,无论如何花费时间去制备样品也无法获得鲜明的图像。因此,Wako专为神经回路分析开发了新的方法——Tetbow法。
大脑中许多神经突起交织在一起,想要清晰全面地观察到其连接并不简单。使用荧光蛋白标记其中一部分神经细胞的话,就可以观察各个突起的连接情况。但是,如果大多神经细胞都染色成同一个颜色的话,就很难去区分。据报道,为了克服以上问题,有人开发了Brainbow这一种可以将3种类型的荧光蛋白结合在一起、将神经细胞染色成数10种不同颜色的方法6),7)。然而,由于Brainbow的荧光亮度不足,所以并不实用。因此,Wako使用Tet-Off系统等开发了比起传统方法高一级亮度的多色标记法——Tetbow法(图6)8)。Tetbow法可以将质粒或病毒载体导入神经细胞中。CFP、YEP、RFP等的荧光蛋白在SeeDB2中均极为稳定,适于使用了SeeDB2的透明化样品中。另外,代替荧光蛋白使用SNAP、HaloTag、CLIP等化学标签的话,可以使用任何合成染料实现多色标记。随着持久亮度逐渐用于实际使用中,多色标记有望成为未来神经回路分析的有用工具。
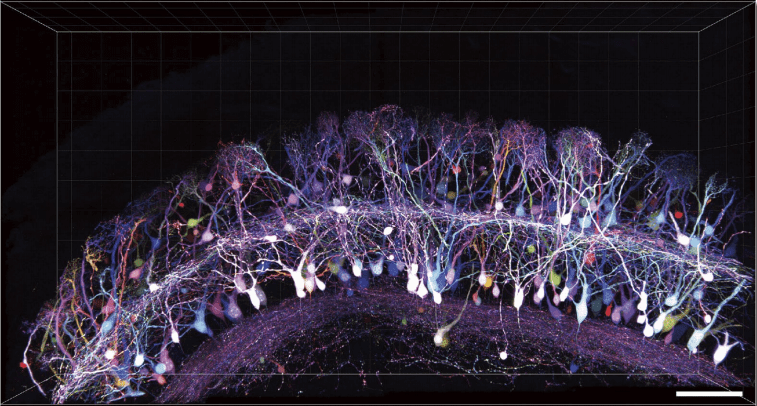
图6. 使用Tetbow的神经细胞多色荧光成像(转载自文献5)
根据使用了质粒的in utero electroporation 法,用Tetbow标记嗅球二尖瓣细胞。比例尺为100 μm。视频可在YouTube查看(https://youtu.be/EHato3VVQTs)。
◆结语
在本文中,以SeeDB2为重点,对高分辨率和高亮度成像的基础知识以及注意点进行了介绍。通过留意物镜的NA和标本的折射率来制备标本,可以从珍贵的标本中获得尽可能多的信息。希望本文可以对今后的荧光成像实验助一臂之力。
◆参考文献
1) Richardson, D. S. and Lichtman, J. W. : Cell, 162 (2), 246 (2015).
2) Richardson, D. S. and Lichtman, J. W. : Cell, 171 (2), 496.e1. (2017).
3) Ke, M. T. et al. : Cell Rep. 14, 2718 (2016).
4) SeeDB Resources, https://sites.google.com/site/seedbresources/
5) Ke, M. T. et al. : Bio-protocol, 8 (20), e3046 DOI: 10.21769/BioProtoc.3046 (2018).
6) Livet, J. et al. : Nature, 450, 56 (2007).
7) Cai, D. et al. : Nat. Meth.,10, 540 (2013).
8) Sakaguchi, R. et al. : eLife, 7, e40350 DOI: 10.7554/eLife.40350 (2018)
◆产品列表
| 产品编号 | 产品名称 | 规格 | 包装 |
| 294-80701 |
SeeDB2 Trial Kit SeeDB2试剂盒小包装 |
组织透明化试剂 | 1 kit |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |