蛋白质实验
蛋白质在生命现象中发挥多种功效,例如活体反应的催化剂、响应刺激、分子运输等。
FUJIFILM Wako不仅可以提供蛋白提取试剂和SDS-PAGE试剂等基础试剂,还可提供高亲和性和特异性的“PA tag系统”和可分离检测磷酸化蛋白的“Phos-tag”产品等特色试剂。
◆什么是蛋白质?
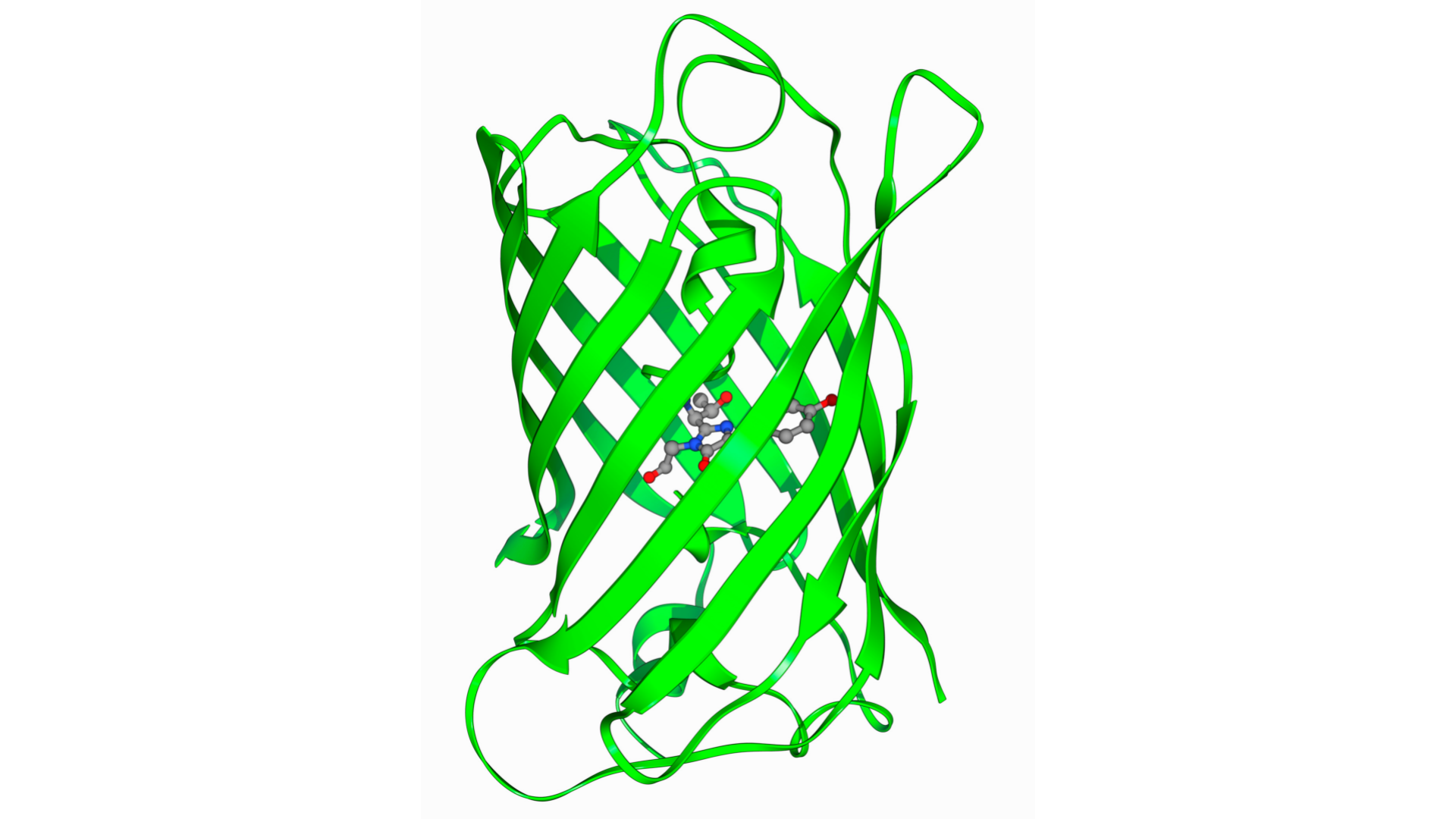
蛋白质是由肽键链接的氨基酸分子,约占细胞组成成分的15%,是生命现象的主要承担者。在生物学中心法则中,DNA的遗传信息转录为RNA,将其翻译形成的最终产物蛋白质。蛋白质根据氨基酸序列显示不同的结构,并根据其结构决定功能。它们的作用多样,如作为体内化学反应的催化剂、参与信号的传递和接收、参与细胞和组织的机械性支持和运动等。
◆蛋白质的结构和功能
生物体内的蛋白质由20种氨基酸组成(表1)、氨基酸序列是决定蛋白结构的主要因素。蛋白质二级结构的基本类型有有α螺旋和β折叠,此外,受极性和非极性氨基酸的分布、半胱氨酸侧链之间是否形成二硫键以及磷酸化等的翻译后修饰因素影响,会形成蛋白质的三维结构。
表1 组成蛋白质的氨基酸
| 氨基酸 | 简称 (三字母) | 简称 (单字母) | 侧链 | 氨基酸 | 简称 (三字母) | 简称 (单字母) | 侧链 |
| 天冬氨酸 | Asp | D | 极性 (负电荷) | 丙氨酸 | Ala | A | 非极性 |
| 谷氨酸 | Glu | E | 极性 (负电荷) | 甘氨酸 | Gly | G | 非极性 |
| 精氨酸 | Arg | R | 极性 (正电荷) | 缬氨酸 | Val | V | 非极性 |
| 赖氨酸 | Lys | K | 极性 (正电荷) | 亮氨酸 | Leu | L | 非极性 |
| 组氨酸 | His | H | 极性 (正电荷) | 异亮氨酸 | Ile | I | 非极性 |
| 天冬酰胺 | Asn | N | 极性 (无电荷) | 脯氨酸 | Pro | P | 非极性 |
| 谷氨酰胺 | Gln | Q | 极性 (无电荷) | 苯丙氨酸 | Phe | F | 非极性 |
| 丝氨酸 | Ser | S | 极性 (无电荷) | 甲硫氨酸 | Met | M | 非极性 |
| 苏氨酸 | Thr | T | 极性 (无电荷) | 色氨酸 | Trp | W | 非极性 |
| 酪氨酸 | Tyr | Y | 极性 (无电荷) | 半胱氨酸 | Cys | C | 非极性 |
蛋白质根据其固有的三维结构,可与特定的分子特异性结合,该分子被称为蛋白质配体。蛋白质和配体的结合主要通过氢键、范德华力、疏水相互作用等相对较弱的键形成。
酶作为蛋白质的一种,与称为底物的配体特异性结合,并催化特定的化学反应。与酶结合的底物和可催化的化学反应由酶的三维结构决定。此外,酶磷酸化修饰或与其他分子结合时都会改变三维结构,同时改变酶活性。
◆蛋白质研究的方法
要阐明蛋白质就需要知道它是什么样的蛋白质(鉴定),它具有什么结构(结构分析),它的功能是什么(功能分析)。以下将介绍蛋白研究中常用的方法。
■ 表达
若已知编码蛋白的基因时,通过导入插入了靶蛋白cDNA的蛋白表达载体至细胞,可在细胞制备靶蛋白。需根据导入的细胞类型、是瞬时表达还是稳定表达、是否添加tag等选择合适的载体。
■ 提取和纯化
从组织和细胞中提取蛋白,需要裂解或破碎细胞。常用含表面活性剂的裂解缓冲液裂解细胞膜或物理破碎细胞。此外,提取膜蛋白时,需要使用能够溶解膜蛋白去污剂(膜蛋白增溶剂)。
蛋白纯化常使用柱色谱法。蛋白纯化时需根据蛋白的形状选择合适的方法,例如离子交换离子交换层析法、凝胶过滤层析法或亲和层析法。若亲和层析法中不存在针对靶蛋白的配体时,可添加亲和标签(表位标签)至蛋白质,并使用该亲和标签的配体进行纯化。
■ 分离和鉴定
使用蛋白质混合液分离特定蛋白时建议使用电泳。最常用的电泳分离法是SDS-PAGE,即使用十二烷基硫酸钠(SDS)加带负电荷后用聚丙烯酰胺凝胶进行电泳。SDS-PAGE可根据分子量分离蛋白。
SDS-PAGE等分离的蛋白可通过质谱法进行鉴定。切除靶蛋白的凝胶,并使用序列特异性蛋白酶(肽酶)在凝胶中碎片化。然后,从凝胶中回收碎片化的多肽,通过质谱分析(LC-MS/MS和MALDI-TOF MS)获取碎片的质量信息,获取得信息通过与数据库比对来鉴定蛋白质。
■ 检测和定量
调查靶蛋白的有无及其表达量需使用特异性结合靶蛋白的分子。另外,抗体由于其特异性被广泛用于蛋白质的检测和定量。使用抗体检测蛋白的方法有通过SDS-PAGE分离的蛋白转移至膜并转录后进行抗原抗体反应的蛋白质印迹法(WB),以及向组织和细胞添加抗体进行抗原抗体反应的免疫染色法等。此外,使用固相化了抗原和抗体的孔板以及酶标记抗体检测靶蛋白的ELISA可以高精度定量样品中的蛋白质。
评估靶蛋白的表达量时,需要比较样品的总蛋白量。定量总蛋白的方法有BCA法、Bradford法、Lowry法、焦性没食子酚红钼络合显色法等等,可使用较为简单地操作进行定量。
■ 修饰蛋白的分析
蛋白的翻译后修饰对其结构和功能的影响很大,尤其是蛋白质磷酸化被广泛用于控制蛋白活性,所以为了调查靶蛋白的磷酸化状态,常使用磷酸化抗体。由日本广岛大学大学院医齿药学综合研究科医学品分子机能科学研究室开发的特异性捕获磷酸化蛋白的功能分子“Phos-tag®”,可不使用磷酸化抗体也能实现磷酸化蛋白的分离、纯化、分析和检测,是一款非常有效的磷酸化蛋白分析工具。
◆参考文献
竹縄忠臣 編:「タンパク質実験ハンドブック」 (羊土社) (2003).
ブルース・アルバーツ、中村桂子 松原謙一 監訳:「Essential細胞生物学 (原書第2版)」 (南江堂) (2005).
岡田雅人、宮崎香 編:「改訂第4版 タンパク質実験ノート 上 タンパク質をとり出そう (抽出・精製・発現編)」 (羊土社) (2011).
岡田雅人、三木裕明、宮崎香 編:「改訂第4版 タンパク質実験ノート 下 タンパク質をしらべよう (機能解析編)」 (羊土社) (2011).