1 比率型荧光pH探针
在各种细胞中,细胞内pH 和Ca2+离子的浓度都是细胞功能的重要调节因子,实时测定细胞内pH对细胞内控制功能的研究十分重要1)。测定细胞内pH的方法有使用微电极法和核磁共振法等2)。其中利用pH灵敏性的荧光色素(荧光pH 探针)进行的荧光探针法与其他方法相比对细胞的侵入性低,可以高灵敏度、高分辨率、短时间间隔地连续检测细胞内pH 的变化3)。目前虽然已经开发出很多种荧光pH探针,但是较为有用的还是能够进行比率测定的荧光pH探针(比率型荧光pH探针)。因为在一般的细胞或生物体的荧光成像中,探针会因周围的环境变化、褪色等影响产生误差,而比率型荧光探针则可以有效地减少这种误差的发生4)。另外能够测定微细胞中的pH变化也是比率型荧光pH探针的优点之一。目前根据比率型荧光pH探针的1波长激发,2波长检测, 从而算出pH的SNARF(seminaphthorhodafluor)法也被广泛了解5)。除了SNARF之外,在细胞内使用通过有机合成制成的荧光探针(有机小分子的荧光探针)时,通常都是从细胞外向细胞内导入荧光探针去检测存在于细胞内的目的离子或分子。为了能够将亲水性高的有机小分子荧光探针导入细胞内使用,必须进行化学修饰提高其亲油性和细胞膜透过性,但这样会使细胞内的滞留性提高,必须再次提高在细胞内的亲水性6)。以上是有机小分子荧光探针通用的解决方法,然而如果提高了亲油性的衍生物自身有很强的荧光,则细胞内和细胞外未反应的残留衍生物会成为背景荧光,影响测定。虽然可以清洗衍生物以减低背景荧光值,但是低贴壁性和悬浮性的细胞难以进行清洗操作,必须要使用另外的方法抑制细胞外荧光探针的荧光。于是我们根据SNARF的结构特征,找到了控制SNARF的荧光特性的有效方法,使用这个方法,成功开发出只在细胞内恢复荧光性的比率型荧光pH探针7,8),以下是详细介绍。
2 以SANRF为基本骨架,自组装纳米探针的设计思路
一部分荧光色素含有二苯并吡喃骨架,这个骨架中含有SNARF。这些荧光色素分为有荧光性的醌型和无荧光性的内酯型(图1)。 醌型的SNARF中还有苯酚型[SNARF(A), λem=583nm]和酚盐型[SNARF(B), λem=627nm] 的平衡存在,这是比率型荧光pH探针能够发挥功能的原因。内酯型[SNARF(L)]是只存在于一般有机溶剂等非极性环境中的分子簇,几乎不存在于水溶液等的极性环境中。上文提及过的提高了细胞膜透过性的SNARF衍生物通过对羟基进行化学修饰提高了亲油性,但由于这些衍生物有来自SNARF(A)的强荧光,从而出现了背景荧光7)。但是如果能够令正常情况下不存在于水溶液中的无荧光性SNARF(L)能够在水溶液中稳定存在的话,就能够构筑一个没有初期荧光的SNARF衍生物,我们通过合成多个SNARF衍生物来了解其结构和荧光特性的关系。SNARF-OMe和SNARFOBn如图2所示。从吸收光谱和荧光光谱可以知道未修饰的SNARF(SNARFOH)9)在测定条件下以SNARF(A)和SNARF(B)的混合状态存在。另外SNARF-OBn即使在水溶液中,也无法观察到SNARF的特征吸收光谱和荧光光谱, 即无法观察到SNARF(A)和SNARF(B)的吸收光谱和荧光光谱,所以我们知道有SNARF(L)结构的存在。根据几个结构学的分析结果证明,SNARF-OBn会在水溶液中形成数十甚至数百种稳定的自组装体,我们推测在形成自组装体所组成的疏水环境中SNARF(L)结构(图3)7.8)。如此合成导入了各种置换基的衍生物,研究其荧光特性发现,以疏水性置换基定数(π)为标准,成功发现自组装状态和分散状态的情况(π=0)(图4)。
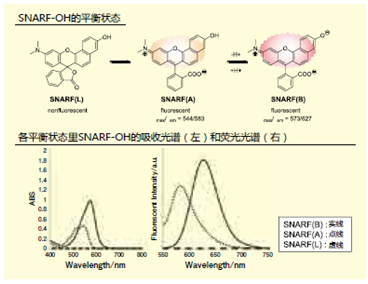
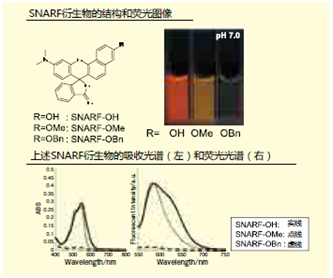
图1. SNARF-OH结构的特征和荧光特性 图2. 特征性SANRF衍生物的结构和其荧光特点
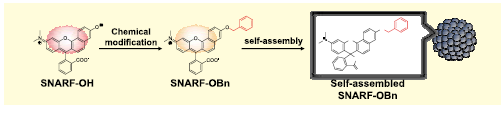
图3. SNARF-OBn的水溶液中自组装过程概念图
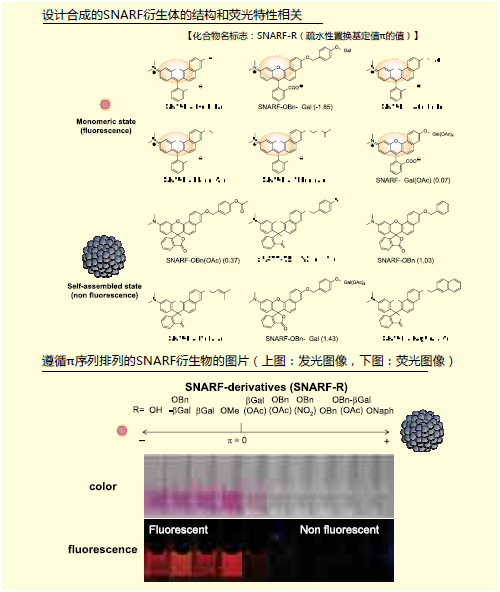
图4. SNARF衍生物结构和荧光特性的相关性
3 细胞内比率型荧光pH探针的展开
由此我们合成导入了和AM基、Ac基一样能通过酯酶加水分解脱保护的乙酰氧基甲酯的SNARF-OBn(OAc)。乙酰氧基甲酯的疏水性置换基定数为0.37,根据上述的设计方法推测其为自组装的形式存在。而实际上SNARF-OBn(OAc)的确在水溶液中是以自组装的形式存在,和酯酶反应前几乎没有荧光。但是在酯酶的存在下通过水解变成分散状态后会慢慢恢复荧光,由于恢复荧光后以SNARF-OH的形式存在,在测定条件下变成能够反映pH 值的SNARF(A)和SNARF(B)的混合状态,根据这个比值能够正确地算出pH 值(图5)。由于SNARF-OBn(OAc)在含血清的培养基中也形成稳定的自组装体,所以无须在不适合培养细胞的无血清培养基中导入细胞7)。另外,SNARF-OBn(OAc)和其他以分散状态存在的酯酶应答性SNARF衍生物相比,能够更有效率地导入细胞中7)。而且由于以分散状态存在的SNARF-OAM初期有荧光, 水解进行到80%以上时,它的比率值会有很大变动,无法算出其正确的pH值。另外,以自组装状态存在的初期几乎没有荧光的SNARF-OBn(OAc)在进行30%程度的水解后,会出现能够反映稳定条件下pH值的比率值8)。这些特征表明SNARF-OBn(OAc)能够减少造成背景荧光的导入细胞衍生物的荧光,是优秀的细胞内pH测定用荧光探针。实际上使用SNARF-OBn(OAc)后, 不仅使用贴壁细胞7),甚至使用浮游细胞8)的荧光成像也无需进行清洗操作,能够只在细胞内发现强SNARF荧光(图6)7,8)。通过活用SNARF-OBn(OAc)的这些特征,给药时细胞内pH的微小变化可以通过酶标仪进行简便的光谱测定和追踪。而使用常规强荧光的SNARF衍生物时,由于细胞内外有未反应的SNARF衍生物会产生背景荧光影响测定,更无法检测出给药时细胞内pH的变化。如果使用SNARF-OBn(OAc),可以对细胞内pH相关的化合物进行HTS分析,SNARFOBn(OAc)也有希望成为新型细胞内pH检测用荧光探针7,8)。
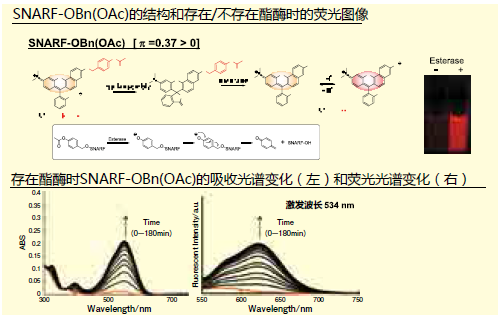
图5. 试管内SNARF-OBn(OAc)的荧光特点

图6. 使用接触性细胞(V79细胞)时的细胞成像。上方为本次研发的细胞内比率型pH探针
4 自组装化纳米探针的设计思路的拓展性
根据本思路,不仅可设计出有酯酶应答性的细胞内pH测定用荧光探针,还可以设计出对各种外部刺激都有应答性的比率型荧光pH探针。所以,可以考虑用在癌症或其他多种疾病里经常表达的、活性很高的酶作为触发器,设计出导入了脱保护的保护基衍生物,成为针对这些患病部位中的高选择性活性化探针。实际上,以在癌症特有的低氧环境中被选择性还原、进行脱保护的硝基苄基10)作为保护基的SNARF衍生物[SNARF-OBn(pNO2)]在不同的氧浓度条件下配制的肝微粒体和培养细胞中,在低氧环境中可以观察到来自SNARF 的强荧光11)。这一发现对以SNARF为基本骨架,有多种应答性的细胞内比率型荧光pH探针的设计有很大的帮助。
5 结语
以上是我们发现的SNARF衍生物自组装和利用其分散状态的独特荧光控制方法,以及利用SNARF的特性设计出的细胞内pH测定用新荧光探针的介绍。最近有研究成功通过使用新型自组装化SNARF衍生物,经微胞饮作用将自组装化SNARF衍生物吸收到细胞内8)。近年,利用荧光色素的集合状态和分散状态的荧光控制方法的聚集诱导发光(AIE,Aggregation Induced Emission)12)和它的逆现象的凝聚引起发光(ACQ,Aggregation Caused Quenching)13) 都非常令人关注,从以细胞内外的特定检测对象为目标的荧光探针的设计思路的。研究例子可以知道,揭示将自身集合的荧光色素衍生物吸收的方法是非常令人感兴趣的成果。而且,在本稿所述,从自身集合的SNARF衍生物转变成内酯型的结构的无荧光化思路中,由于在可见光领域的SNARF特有的吸收消失,诱发反应前后的高效率荧光变化和对在反应前阶段的激发光的高稳定性让人好奇。这个结构变化并不局限于SNARF衍生物,也可以延伸到其他荧光色素的骨骼中,为了拓展这个思路,必须要知道结构和荧光特性的相互关系。
相关小知识
荧光探针
通过和特定的分子反应改变分子的结构,使荧光强度、荧光波长都发生变化的功能性分子。
比率测定
通过对有不同变化的2波长的荧光强度的比进行定量的测定法。可以减小目标分子浓度变化以外的因素(因
探针局部不同而产生的强度差和褪色、自发荧光等)。
疏水性置换基定数
在1964年由Hansch和藤田一起提出,用公式表示化学构造和生物活性之间的关系,然后进行定量解析的方法QSAR(定量结构活性相关Quantitative Structure-ActivityRelationship)的参数之一——π。
聚集诱导发光(AIE, AggregationInduced Emission)聚集起因消光(ACQ, AggregationCaused Quenching)
荧光色素在高浓度的溶液中和固体上形成聚集体时,由于其聚集状态的分子结构,形成有荧光性的聚集体和没有荧光性的聚集体时有很大的不同。前者和后者都有不同的现象,称为聚集诱导发光火聚集起因消光。详细参考文献12-13。
产品编号 | 产品名称 | 规格 | 应用 |
Probe pH nano (UTX-40) | 1 mg | 细胞生物学 | |
obe pH classic | 1 mg | 细胞生物学 |
参考文献:
[1] Srivastava, J. et al. : Physiology, 22, 30 (2007).
[2] (a)Willmann, J. K. et al. : Nat. Rev. Drug Discovery, 7, 591 (2008).(b) Hargreaves,R. J.: Clin. Pharmacol. Ther., 83, 349 (2008).
[3] Han, J. and Burgess, K. : Chem. Rev., 110,2709(2010).
[4] Demchenko, A. P. : J. Fluoresc., 20, 1099(2010).
[5] Whitaker, J. E. et al. : Anal. Biochem., 194,330(1991).
[6] Haugland, R. P. et al. : “The Handbook : A Guide to Fluorescent Probes and Labeling Technologies”
,Molecular Probes, Eugene,OR, 10th ed.(2005).
[7] Nakata, E. et al. : Chem. Commun., 46, 3526(2010).
[8] Nakata, E. et al. : RSC Adv., 4, 348 (2014).
[9] 本研究里, 为了合成简单在设计阶段省略了C.SNARF-1 里存在的5 位或6 位的羧基。存在5 位或6 位的羧基时也可通过设计形成自组装体。
[10] (a) Chen, Y. and Hu, L. Q. : Med. Res. Rev.,29, 29(2009). b) Jaff ar, M. et al. : Adv. DrugDeliv.Rev., 53, 217 (2001).
[11] Nakata, E. et al. : Bioorg. Med. Chem., 17,6952(2009). 本论文发表时,虽然未言及荧光变化机制,但后续的讨论有参考本研究思路。
[12] (a)Hong, Y. et al. : Chem. Commun., 4332(2009). (b) Wang, M. et al. : J. Mater.Chem.,20, 1858(2010). (c) Hong, Y. etal. : Chem.Soc. Rev., 40, 5361 (2011).
[13] (a) Briks, J. B . : “Photo physics of Aromatic Molecules”, Wiley, London, p. 718(1970). b) Kobayashi, H. and Choyke, P.L. : Acc.Chem. Res., 44, 83 (2011). (c)Lakowicz, J. R. :“Principles of Fluorescence Spectroscopy”,Springer, New York, 3rd ed., p.331 (2006).
[14] (a)Ogawa, M. et al. : ACS Chem. Biol.,4, 535(2009).(b)Mizusawa, K. et al. : J.Am. Chem.Soc., 134,13386 (2012).(c)Lukinavičius, G. etal. : Nat. Chem., 5, 132(2013)
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |