-微量元素分析- 各领域中的应用实例及其重要性

株式会社 住化分析中心 TS 本部 大阪实验室 物性特性 G 西岡利奈様、花河奏一郎
1. 前言
针对药品元素杂质的监管,日本在2015年9月30日发布了《关于药品元素杂质指南》(药食审查发0930第4号),以国际人用药品注册技术协调会(ICH)的元素杂质指南为基础。近日,日本药典的第17次修订版的第二追补版(2019年6月28日 厚生劳动省告示第49号)中,收录了以元素杂质指南为基础的参考信息《药品中的元素杂质控制》。并且,在2021年6月公布的第18次修订版中,追加了元素杂质控制的规定,并修改了一般试验法。本次修订的概要将在下一节介绍。
本文将概述元素杂质控制中的重要环节——产品风险评估,并简单介绍其步骤。并将介绍一个关于风险评估的实际案例。
2. 日本药典第18次修订版中的修正内容
日本药典第18次修订版通则34中新收录了元素杂质控制条目,并追加了对于日本药典中的制剂,原则上要遵从一般试验法中的元素杂质相关的规定进行适当控制的内容。对于制剂、原料药以及辅料等,在告示实施后的36个月内(2025年6月为止)需按照指南进行相应的控制。
对于元素杂质的检测方法,综合了一般试验法“2.66元素杂质测试法”和参考资料“制剂中元素杂质的控制”进行修订。此外,ICH Q3D《关于药品的元素杂质指南修订》(2020年6月26日药生药审查发0626第1号)修订了镉每日允许暴露量的数值。
鉴于该指南发布已过去36个月,现决定将现有制剂也纳入到适用范围内,未来元素杂质的评估和控制也会越来越重要。
虽然ICH元素杂质指南适用于申请生产的新药以及上市销售的新药,但是对于药典收录外的医疗用药品也在2020年12月28日的《关于医疗用药品相关元素杂质的处理》(药生药审查发1228第7号)中被列入控制的适用范围中,并要求进行相同的元素杂质控制。
3. 风险评估
元素杂质的风险评估步骤根据以下几步进行:
确认
确认制剂的生产过程中元素杂质的来源
评估
通过比较制剂中元素杂质的实测值或预测值和每日允许暴露量(PDE:permitted daily exposure)进行评估。
总结
总结记录风险评估的结果,确认控制是否充分。
讨论是否需要追加减少元素杂质的控制方法。
通过重复以上步骤,可设定合适的控制方法
3.1. 确认元素杂质的来源
制剂的生产过程中潜在的元素杂质有以下几种来源:
● 在原料药。辅料或其他药品成分的生产过程中,有意添加元素(催化剂)的残留杂质
● 非有意添加且潜在存在于药品生产所用原料药、水或辅料中的元素杂质
● 由生产设备潜在引入到原料药和/或制剂中的元素杂质
● 由容器密封系统潜在浸出至原料药和制剂的元素杂质
图1列举了制剂过程中的组成要素。在风险评估中,必须要考虑各项要素中潜在杂质来源的元素杂质含量对制剂元素杂质总量的影响
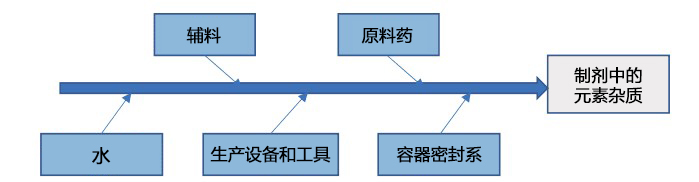
图1. 元素杂质的潜在来源
风险评估的常见方法中,有侧重于各组分的元素杂质“组分法”和侧重于成品元素杂质的“制剂法”。图2总结了各方法中需考虑的杂质来源。对于这些杂质来源,需收集支持数据,例如已发表的文献、供应商提供的信息或测试结果,并确认哪些元素杂质会有较大的影响。
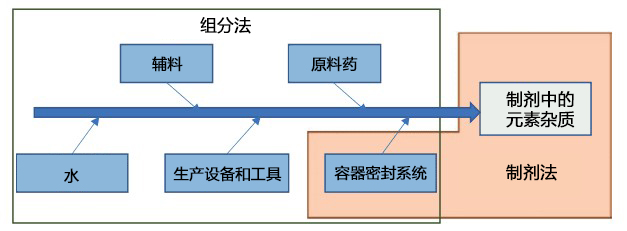
图2. 风险评估的方法
为了加深理解,元素杂质指南提供了由 10 个模块(0-9)组成的训练方法。该方法在训练方法模块5中有详细的介绍,具体可参考元素杂质指南。
3.2. 评估元素杂质(PDE值和允许浓度间的换算)
若能确认杂质来源和对象元素,可比较制剂中的各元素杂质中的实测值或预测值与设定PDE值 ,并对元素杂质进行评估。为比较PDE值与实测值或预测值,指南中收录了4种换算方法,分别为方法1、2a、2b以及3来将PDE值换算为允许浓度。组分法从方法1、2a以及2b选择合适的方法进行换算。制剂法由于是评估成品,所以使用方法3进行换算。(评估相关的详细信息请查看指南第7项)
3.3. 控制元素杂质
指南中的控制阈值定义为 PDE 值的 30%。当元素杂质的量低于控制阈值时,则不需要额外的控制。当存在高于控制阈值的可能性,但低于PDE值时,需要采取措施减少元素杂质量。例如,上游控制,重新选择组分以及容器密封系统,或重新建立标准等。
若高于PDE值时,则需要采取进一步的控制措施。但是,当技术上无法实施控制措施时,如培训方法模块6所示,可在特定的情况下通过说明安全性也或可接受。
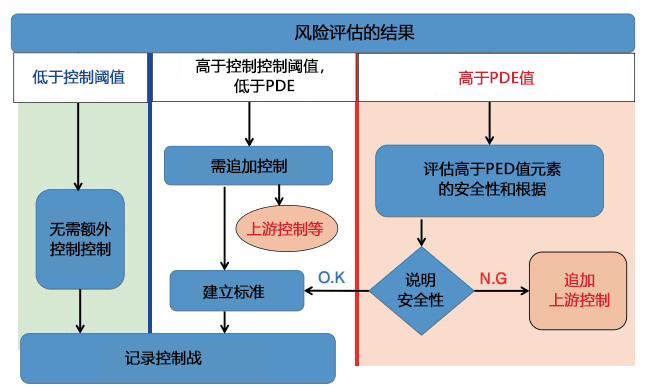
图3. 元素杂质的控制
4. 通过筛选进行初步评估
风险评估的方法有很多种,使用制剂法时,首先需收集制剂中的元素杂质量相关的数据,决定需要评估的元素。若元素杂质相关的数据不足时,需要实际测定制剂中元素杂质的含量。以ICH Q3D的对象24元素设定的允许浓度的控制阈值进行比较分析(筛选分析),是有效锁定对象元素的方法之一。
以下将介绍一个以注射剂为例的虚拟筛选分析示例:
给药路径:注射
每日最大给药量:2 mL
对象元素:Calss 1、2A、2B以及3(24元素)
方法:3
定量范围:PED值要求的允许浓度10%或以下。
使用设备:ICP-MS
表1为进行了筛选分析的部分对象元素的允许浓度、控制阈值、定量范围以及结果
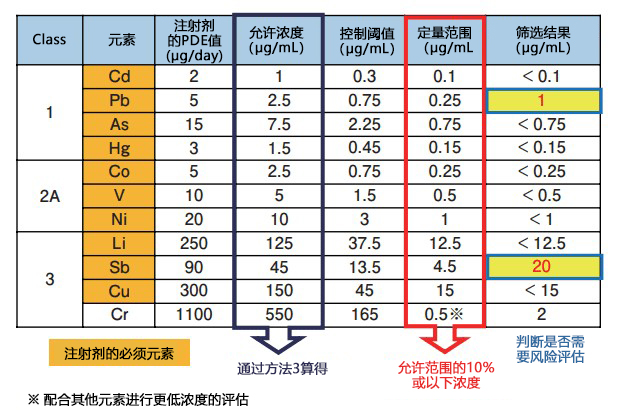
允许浓度通过方法3,使用注射剂的PDE值除以一天的最大给药量(2 mL)计算所得。此案例将定量范围设定在允许浓度的10%或以下。如Cr这类允许浓度特别高的元素,测定时的定量范围要配合其他元素,使用较低的浓度进行评估才能确认元素杂质。如案例所示,不同对象元素的允许浓度也不同,所以制备标准溶液使用已设定浓度的ICH Q3D用市售混合标准液可以减少稀释工作从而制备精度较高的标准溶液。
该案例的筛选结果显示,Pb和Sb的检查结果在控制阈值以上,需确认杂质来源,控制上游原材料。视情况,还需要追加建立注射剂标准等额外控制。注射剂中不仅有制剂中的元素杂质,还存在制剂在有效期内包装成分溶出的风险。因此需要收集稳定性测试和恶劣条件下的测试数据,以及从材料厂家获取的信息等通过其他途径进行评估从容器密封系统中混入的风险。
5. 总结
本文以使用注射剂进行筛选评估方法为例,介绍了风险评估的相关方法。元素杂质的风险评估根据给药路径和组分的不同,需根据实际情况进行适当地处理。除了指南,我们还建议参考指南中提供的补充信息中的培训教程,以及辅料相关的国外文献数据等相关信息。如第 2 节所述,日本药典第18次修订版在发布后的36个月内,指南和基于新药典规定的元素杂质控制要求,对于日本药典所含制剂以及非日本药典的制剂都同样适用,因此日后还需对元素杂质控制多加注意。
”-微量元素分析- 各领域中的应用实例及其重要性”系列寄语
电子材料(半导体)、水质分析、食品以及药品中的微量元素控制是必要的。在第18次修订版日本药典(JP18)中,收录了药品的元素杂质的控制和测试方法。预计今后微量元素分析的也会越来越重要。
本系列共4回,分别从半导体、环境、药品、食品这4个领域入手,介绍各领域中微量元素分析的案例。
希望本系列能够为您的研究尽一份绵薄之力。
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |