具有神经细胞保护效果的Xeno free 营养因子
![]()
香川大学医学部 药物生体情报学讲座 塚本郁子老师
◆前言
COA-Cl是由笔者的研究团队合成的新型化合物,于2010年命名为“2Cl-C. OXT-A”并销售。虽然是作为促进血管生成的小分子产品被推出,但在之后的研究中发现COA-Cl除了对神经细胞具有保护营养效果以外,还有各种各样的生理活性。恰逢该试剂更名为“COA-Cl”并重新开售,借此机会,本文将介绍有关COA-Cl的最新研究进展。
◆COA-Cl的结构
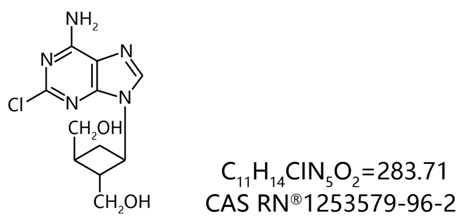
COA-Cl是由德岛文理大学香川药学部合成的新型化合物。它以从微生物中分离出的具有抗病毒活性的核酸衍生物Oxetanocin A为基础骨架,将其中的氧杂环丁烷环(C-CC-O的环醚)替换为环丁烷环(Carbo Oxethane)并在腺嘌呤碱基上引入了Cl(图1)。
水溶性<20 mM 室温稳定
图1. COA-Cl的结构
其旧称2Cl-C. OXT-A 意为由2 号位的氯、经碳化的氧杂环丁烷环 (Carbo Oxetane) 和碱基(Adenine,腺嘌呤) 结合而成的化合物,而COA-Cl为这个旧称的缩写。COA-Cl最初发现的生理活性为具有促进血管生成的功效。在研究了数十种COA-Cl衍生物的血管生成作用后,发现COA-Cl的活性最高。
◆血管生成作用
COA-Cl的促进血管生成作用已在使用血管内皮细胞HUVEC和成纤维芽细胞NHDF的共培养系统中的管腔形成实验以及鸡绒毛尿囊膜 (CAM)和兔角膜的体内(in vivo)实验中被证实1)。虽然单独培养HUVEC不会形成管腔,但是进行共培养的话,它会接收到从NHDF中分泌的血管内皮细胞增殖因子(VEGF)的信号而开始形成管腔(图2)。
然而,COA-Cl对HUVEC中的VEGF受体活性不会产生直接影响2)。因此,作者将研究对象转移到神经鞘氨醇单磷酸 (S1P),一种不同于VEGF的血管生成促进因子,并使用了siRNA和各种抑制剂对其进行了研究。结果表明,COA-Cl通过S1P1受体激活MAP激酶并促进 HUVEC2) 的管腔形成。

图2. 通过COA-Cl促进HUVEC的管腔形成
除了对HUVEC的作用,添加COA-Cl至NHDF还能促进VEGF的分泌(图3a)。研究发现,作为促进VEGF基因表达的细胞内信号转导途径,与通过缺氧诱导的转录因子HIF-1α以及代谢相关的转录辅助因子PGC-1α(PPARγcoactivator 1α)这两种因子有关(Nature, 451, 1008 (2008) )。
虽然在NHDF细胞中,COA-Cl并没有给HIF-1α带来什么变化,但是在基因和蛋白水平上诱导了PGC-1α(图3b)。另外,从诱导cAMP的浓度上升以及CREB的磷酸化的增强中可以看出,在缺氧条件下,在NHDF中COA-Cl促进VEGF的分泌作用并不是通过HIF-1α途径进行,而是通过PGC-1α激活途径进行的3)。因此,COA-Cl的促进血管生成作用可总结为在血管内皮细胞的S1P1受体的介导作用以及在NHDF等周边细胞中促进VEGF分泌。
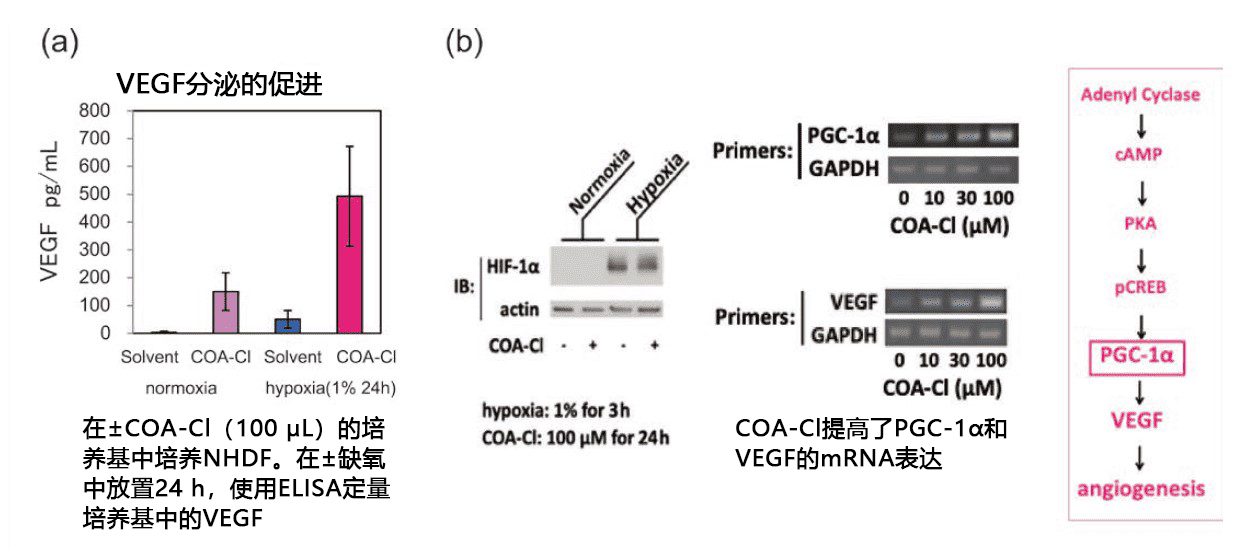
图3. COA-Cl的VEGF促进作用
◆对神经细胞的保护营养作用
由于已证实COA-Cl对MAP激酶有激活作用,所以也预期它对神经细胞有突出伸长作用。因此使用神经模型细胞PC12进行验证发现,COA-Cl具有对ERK1/2的激活和突出伸长作用。
另外,当细胞在应激状态下如缺氧或低营养(不含葡萄糖)时,检测细胞毒性标记物LDH的活性时发现,无论是在应激前给药,还是在应激后给药,COA-Cl都有相同的保护作用(图4b)。
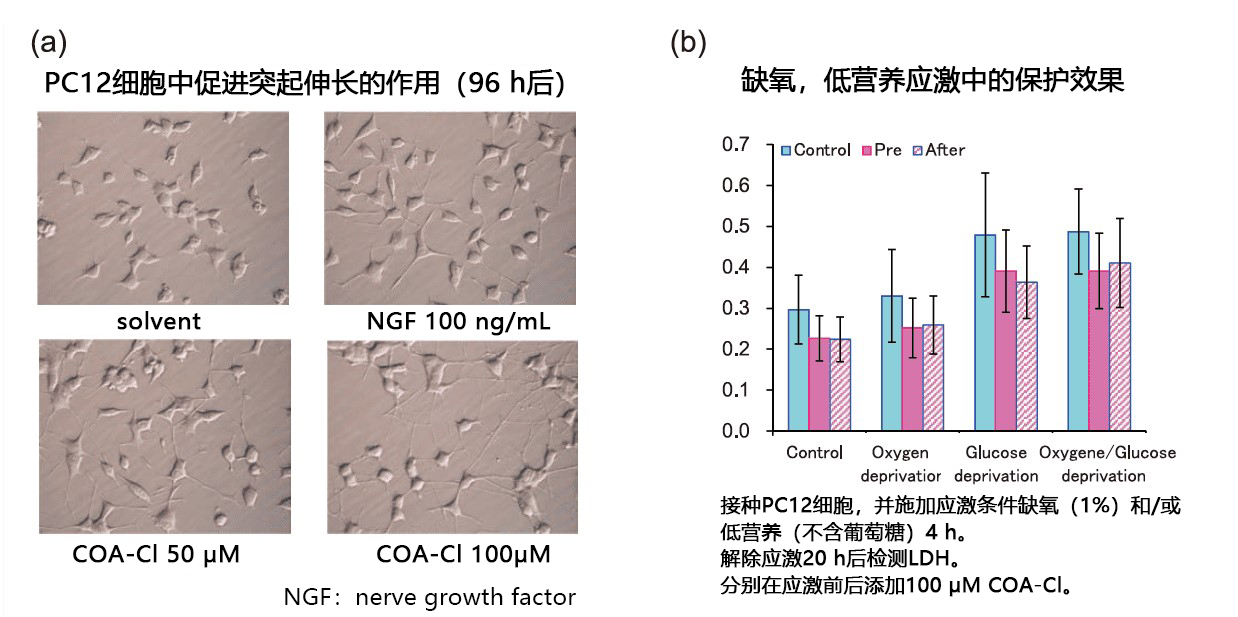
图4. COA-Cl的神经细胞保护营养效果
从应激后给药也有效的结果来看,COA-Cl或许在脑梗塞等缺血性病症发病后给药也可以获得效果,并且有望作为新药种子。此外,除了对无血清应激的保护作用外(图5),它对过氧化物引起的应激也有保护作用(保持细胞活力,减少细胞凋亡)。对于目前蓬勃发展的再生医学领域来说,细胞培养过程正需要Xeno free 原料。COA-Cl不仅仅是常温稳定的小分子,还可以作为血清代替物和Xeno free 营养因子发挥作用。

图5. 无血清应激中的保护作用
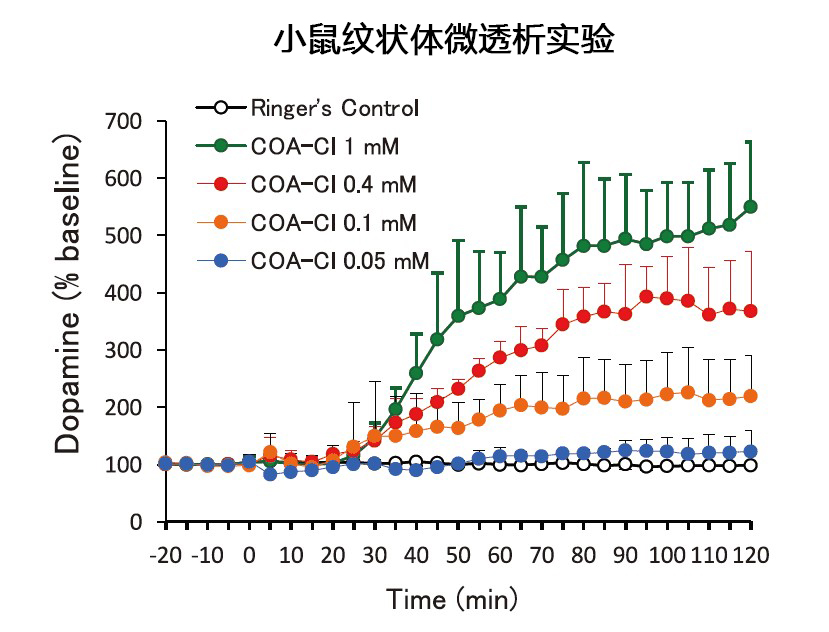
图6. COA-Cl的多巴胺分泌促进作用
COA-Cl不仅可以在PC12中诱导ERK1/2活化,还能诱导酪氨酸羟化酶(TH)的活化。TH是儿茶酚胺在生物中合成的限速酶,实际上在培养基中也观察到多巴胺(一种儿茶酚胺)浓度的上升。此外,将微透析探针置于小鼠的大脑内(纹状体),并回流含有COA-Cl的林格氏液,定量检测含有脑脊液的回收液中的多巴胺后发现,多巴胺浓度如图6所示呈浓度依赖性上升4)。多巴胺与帕金森病等多种神经退行性疾病密切相关。目前神经退行性疾病的有效治疗药物很少,期望COA-Cl能在该领域发挥作用。
◆病理模型动物实验
血管生成作用和神经保护营养效果对受疾病影响的生物体来说是重要的作用。因此,研究人员使用病理模型动物对COA-Cl的效果进行研究。在脑缺血和脑出血模型大鼠以及心脏缺血模型小鼠中,已确认在发生损伤后给药COA-Cl可减少受损体积并改善预后 5-7)。另外,还有报告称COA-Cl还能改善阿尔茨海默病的记忆学习能力8)。
◆COA-Cl的可能性
如上所述,COA-Cl具有各种各样的生理活性,有望作为候选新药以及Xeno free 营养因子。此外,COA-Cl还具有抑制组织纤维化相关的结缔组织生长因子(CTGF)的作用,以及抑制TGFβ1诱导的组织纤维化和上皮间充质转化(EMT)的作用9,10)。由于篇幅有限,本文未能一一尽述。
目前, COVID-19、禽流感和埃博拉出血热等病毒性疾病引发了重大社会问题,而COA-Cl原本就是抗病毒药物的衍生物。笔者对COA-Cl对于这些病毒是否具有抗病毒活性兴趣颇深。COA-Cl作为在室温稳定的水溶性小分子,在新药研发上有一定优势。希望以这次的重新发售为契机,可以进一步推进COA-Cl研究,并为人类健康作出贡献。
◆谢辞
COA-Cl的研究始于德岛文理大学香川药学部的丸山徳見老师和榊原紀的新型合成。以及有赖相继开展研究的参考文献中的各位共同研究人员们的合作,才有了现在的COA-Cl。借此机会,对各位研究人员表示衷心地感谢。
◆关键词
Xeno free
不含非人来源成分。常用于描述细胞的培养环境。在生产用于再生医疗中的细胞加工产品时,Xeno free 的培养环境是较为理想的,不使用FBS等动物来源营养因子的培养试剂的开发备受期待。
◆参考文献
1. Tsukamoto, I. et al. : Biochem. Biophys. Res. Commun., 399, 699 (2010).
2. Igarashi, J. et al. : Pharma. Res. Per., 2, e00068 (2014).
3. Jamal, M. et al. : Brain Res., 1706, 68 (2019).
4. Okabe, N. et al. : Brain Res., 1506, 115 (2013).
5. Lu, F. et al. : J. Stroke Cerebrovasc. Dis., 25, 2637 (2016).
6. Nishikido, T. et al. : Sci. Rep., 9, 2533 (2019).
7. Kishimoto, Y. et al. : Data Brief, 20, 1877 (2018).
8. Kawami, M. et al. : Drug Methab. Pharmacokinet., 32, 224 (2017).
9. Nakai, K. et al. : J. Dermatol. Sci., 94, 205 (2019).
10. 榊原紀和 他:BIO Clinica, 33, 39 (2018).
相关产品
点击此处查看相关产品:COA-Cl【2-Cl-C.OXT-A】
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |