阐明BDNF-从基础到临床-
![]()
香川大学 医学部 铃木辰吾
◆前言
BDNF是神经元以神经活动依赖性方式释放的神经营养因子,诱导突触重组,并参与记忆与学习。另外,BDNF在发育中的大脑还具有维持神经元的存活和分化诱导、诱导突触形成和突触结合等多种作用。虽然其有着重要作用,但目前仍未能完全认识其功能的本质。近年研究表明,发育过程中的BDNF的表达下降可能与神经回路形成异常相关,这种异常可能与发育障碍相关。因此,本文将对发育期大脑中BDNF的表达、功能和作用,以及BDNF和发育障碍的关系进行阐述。
◆发育期大脑中BDNF的表达
BDNF在大脑的广泛区域中表达,尤其在海马体、扁桃体、大脑和小脑等中呈高表达状态1,2)。在大脑皮层和海马体中,主要在兴奋性神经元中表达量多,除神经元外,在小胶质细胞等中也有表达。已确认小鼠胚胎生成11.5 天后,BDNF可在其大脑中表达,出生后表达显著上升3-5)。
由于BDNF表达受神经递质GABA和谷氨酸,以及去极化引起的细胞内钙离子信号的影响,通过这些神经科学因素和发育依赖的转录因子的表达变化及其组合,BDNF表达应该是随着产后发育不断上升。另一方面,在这一时期,与BDNF高亲和性受体TrkB的表达无明显变化。
众所周知,DNA的甲基化会抑制BDNF的表达6)。许多报告表明,在应激动物模型和人病理学中观察的BDNF表达减少与DNA的甲基化相关。
另外,已证实miRNA和内源性BDNF反义RNA的存在可抑制BDNF表达7,8)。BDNF表达为受到各个不同表达调控的大部分转录物,由于所有的mRNA都具有相同的编码区域,所以只会产生相同氨基酸序列的BDNF蛋白。因此,BDNF转录物的多样性,并不会产生蛋白序列多样性,而是产生时空结构表达模式的多样性9)。例如,BDNF的mRNA无论是结构性转录还是神经活动依赖性转录,产生的是不同的转录物。此外,BDNF作为加工体合成,并通过切断成为成熟型BDNF10)。加工过的成熟型BDNF部位的氨基酸序列被高度保守,在人、小鼠和大鼠之间毫无差异。
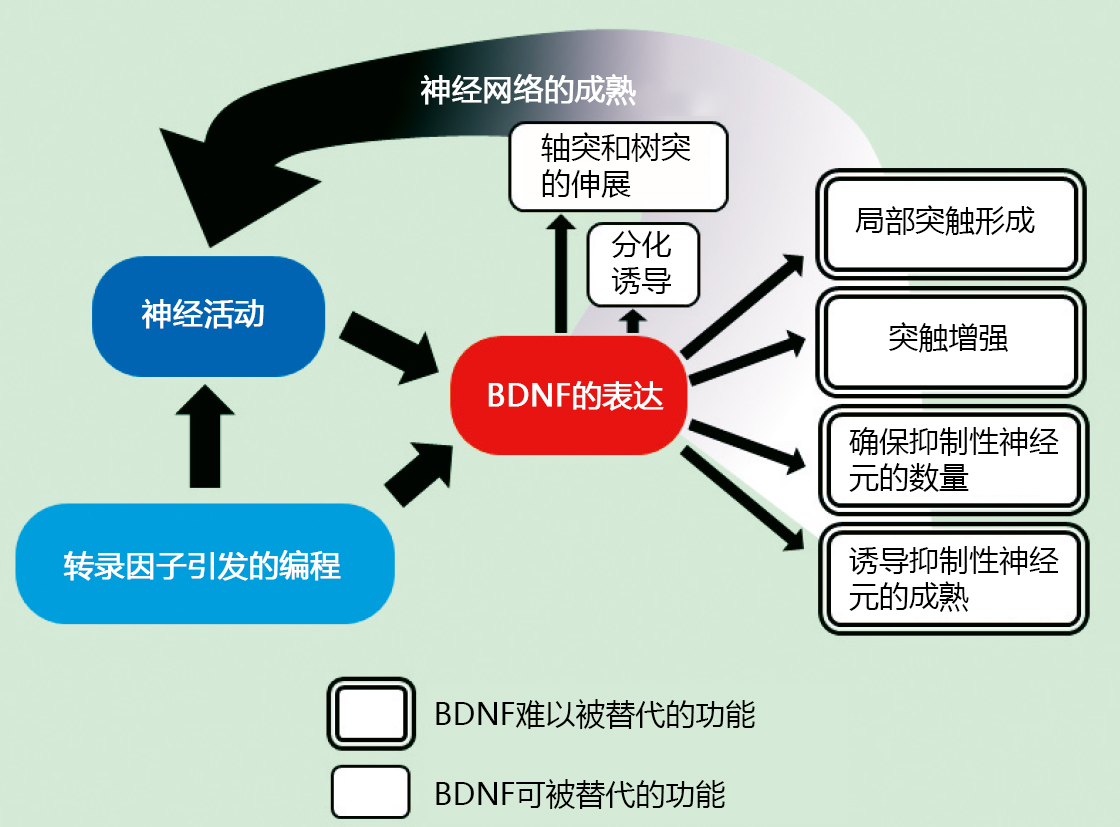
图. 发育期BDNF的功能
◆BDNF对神经元的活性
BDNF可赋予发育中神经元多种多样的活性。首先,可以促进神经干细胞的增殖和向神经元分化。此外,BDNF可维持神经元的存活,诱导细胞移动,以及增加轴突和树突的分支,树突的数量等11)。另外,BDNF在诱导突触成熟的同时,还可诱导突触数的增加、突触后肥大、突触间神经科学性结合的调整以及促进其长期增强12)。
另一方面,根据组织的不同,BDNF还具有促进轴突修剪等作用13)。这些作用是在不同时期大脑的不同部位,通过不同的实验系统观察到的现象。
◆发育期BDNF的显著作用
由于BDNF具有上述作用,若缺乏BDNF,有可能无法构建神经回路。但意外的是,敲除BDNF的小鼠大脑结构比我们预估的更接近正常。当然,BDNF缺乏的影响还是很明显,大部分的BDNF 敲除小鼠都会由于心脏发育不全等非脑组织的影响,在出生后几天死亡,但也有部分个体可以存活2~4周14)。在其大脑中,原本BDNF高表达的大脑皮层以及海马体,也没有观察到部分缺乏以及层结构严重紊乱等的变化。这表明BDNF具有的大部分活性,都可以被其他的内在因子代替。由于BDNF是出生后表达上升的蛋白,因此认为其在大脑发育中的特异性功能是在出生后发挥的。实际上,在存活的BDNF敲除小鼠、杂合子敲除小鼠和神经元中特异性缺乏BDNF的小鼠中,发现其出生后形成的神经回路和神经回路形成后突触间的信息传递出现异常15)。在个体中,观察到它们存在学习、记忆障碍和行为异常的现象。因此, BDNF难以替代的核心功能是对出生后神经回路的形成和维持大脑功能的贡献。在胚胎期构建未成熟的大脑神经回路,通过出生后环境的刺激和经历的反映逐渐成熟和完整。BDNF是这后半程或之后最能发挥其特性的因子。
缺乏BDNF的另外表现之一是抑制性神经元在海马体和大脑皮层中的数量减少14)。抑制性神经元在细胞移动后会静止并被局部的回路摄入,面临存活竞争。另一方面,在BDNF的敲除小鼠中,并未发现兴奋性神经元数量的变化。由于BDNF在兴奋性神经元中高表达,所以从兴奋性神经元中分泌的BDNF可以促进抑制性神经元的移动。然后,通过促进存活竞争,调整局部抑制性神经元的数量。这个时期有大量可诱导神经元存活的因子,所以抑制性神经元的存活尤其依赖于BDNF。
另外,在观察杂合子敲除小鼠及条件敲除小鼠的大脑皮层及海马体中,认为BDNF相对轴突进展和诱导,更大的作用是对外周分叉和突触发生本身的影响16)。同样,由于BDNF也影响树突和分支的数量,BDNF首先为促进轴突和树突分叉以增加突触数量奠定基础,然后通过诱导突触发生,实际增加突触的数量。然而,由于已知 BDNF 也有助于小脑和视网膜中的突触和轴突修剪,因此 BDNF 对整个大脑突触发生的影响不是唯一的。 此外,使用成熟后的海马切片的研究表明,BDNF 选择性地从单个树突上的刺中释放,并能诱导突触特异性的长期增强 17),并从树突和细胞体中释放。据报道, BDNF 主要作用于附近的神经元 18、19)。 由此认为,BDNF即使在发育过程中也可以通过局部释放来相对增加局部范围内的突触数量。
BDNF还与抑制性神经元的成熟相关。在强制表达BDNF的小鼠中,促进抑制性神经元的发育,提前结束抑制性神经元发育依赖的视皮层的临界期5)。实际上,通过感觉刺激活化的神经元释放的BDNF和产生的基因程序引起表达上升的BDNF,两者的总和调节了抑制神经元的发育,并决定了临界期的结束。在进入临界期前的BDNF敲除小鼠的桶状皮层中,可以观察到小白蛋白阳性的抑制性神经元的电生理性质和未成熟的形态20)。由此可以看出,BDNF对抑制性神经元的成熟诱导作用对于临界期前期的局部回路形成非常重要。为正确形成大脑皮层的局部回路,需要按顺序活化神经元种类21),发育阶段BDNF瞬时的表达变化,可以会对局部回路的结构以及成熟后的大脑功能产生影响。在成熟的大脑中,小白蛋白阳性抑制性神经元在间隙连接处结合,主导同步活动和节律形成。因此,发育阶段的BDNF表达降低可能会影响局部的回路形成以及同步放电,从而影响大脑的功能。据报道,使用转基因小鼠对小白蛋白阳性抑制神经元中 BDNF 信号传导的特异性抑制,会影响同步活动和节律形成 22)。
虽然研究人员长期以来一直有研究BDNF 参与成熟后海马体兴奋性神经元形成的神经网中的突触增强23),但发育阶段BDNF的作用仍未阐明。从BDNF对海马体和大脑皮层的兴奋性神经元的树突上存在的突触的数量和成熟的积极影响可以看出,BDNF也许会影响兴奋性神经元间的结合。兴奋性神经元构建的神经网是信息处理系统的主干,并参与广域网的链接,因此阐明BDNF在这些回路形成中担任何种角色的研究备受期待。
◆BDNF和发育障碍的关系
有假设提出,包含胚胎期在内的发育阶段的应激会诱导BDNF的表达降低,其结果可能会抑制正常大脑的发育,并成为发育障碍和精神疾病发病的原因。为验证这一假设,在负荷各类应激的模型动物中确认BDNF的表达的变化24)。在胚胎期,通过对母体施加束缚应激和心理应激,在海马体中观察到了BDNF的表达降低以及DNA的甲基化24)。此外,产后的母婴分离应激还会使海马体和前额叶皮层的BDNF表达降低,突触数量减少4)。
母婴分离应激导致的BDNF表达降低,随之还引起了组蛋白甲基化状态的变化和控制BDNF表达的miRNA的表达增加24)。然后,在胚胎期和新生儿期受应激的动物,发育后会观察到其社会性下降和焦虑行为。所以,发育阶段BDNF的表达降低对发育过程中神经回路的形成有一定的影响,其可能在个体成熟后造成影响。考虑到发育期BDNF的作用,应激造成的BDNF表达降低,即使只是一时性的或局部性的,也可能会对个体产生永久性的影响。
对于人类,有大量的研究报告显示血液中BDNF浓度和精神疾病相关。血液中的BDNF被认为来源于血小板,但其本身的意义尚未阐明。然而,大脑中BDNF的甲基化和血液中的BDNF甲基化,虽然在个体中各有差异,并未发现其相关性,但在同一个动物实验中是相关的25),因此,在处理人血液中BDNF浓度的实验结果时,可以外推为一组大脑反应。
在精神疾病中,与血液中BDNF的相关性研究较多的是自闭症谱系障碍。已确认自闭症谱系障碍患者的血液中BDNF含量上升,在新生儿检测中,显示血液中BDNF的水平降低和自闭症谱系障碍的发病有主要关联26)。因此,在自闭症谱系障碍中,研究人员认为BDNF的表达在大脑发育阶段低,大脑成熟后升高。有趣的是,在负荷了母婴分离应激的动物中也能观察到同一现象。被施加了母婴分离应激的动物,除了在发育阶段观察到BDNF表达降低以外,当母子分离应激结束后,BDNF的表达相对于正常组升高4)。结合所了解的各类现象,虽然未阐明的现象仍有许多,但可以假设发育阶段的BDNF瞬时表达降低会抑制抑制性神经元的成熟,导致兴奋性神经元的活动变活跃,并释放更多的BDNF。
另外,还有报告称注意力缺陷多动障碍 (ADHD) 与血液中 BDNF 之间的关系从发育阶段到成人有所降低 27),但仍未阐明。BDNF 功能下降导致黑质多巴胺能神经元发育下降并参与 ADHD 的发病,这一假设补充了BDNF的降低和ADHD的相关性。另外,这一假设还得到了多项研究的支持,研究表明BDNF 对黑质多巴胺能神经元的存活、发育和分化有强烈影响。
◆结语
至今为止的大部分基础研究,都阐明了发育阶段BDNF的作用。然而,仍未完全阐明其在构建神经回路时的作用。其主要原因是因为研究人员目前正在阐明神经回路的结构和动作原理,但BDNF在其中发挥的作用仍是不容忽视的。通过不断阐明BDNF在这个黑匣子中的作用,明确其与发育障碍的相关性,并参与治疗方法和干预方法的开发备受期待。
◆参考文献
1. Hofer, M. et al. : EMBO J., 9, 2459 (1990).
2. Timmusk, T. et al. : Neuron, 10, 475 (1993).
3. Pöyhönen, S. et al. : Front. Physiol., 10, 486 (2019).
4. Ohta, K. I. et al. : J. Neurochem., 141, 179 (2017).
5. Huang, Z. J. et al. : Cell, 98, 739 (1999).
6. Zheleznyakova, G. Y. et al. : Behav. Brain Funct., 12, 17 (2016).
7. Zhang, Y, et al. : Biomed. Pharmacother., 80, 207 (2016).
8. Lee, S. T. et al. : Ann. Neurol., 72, 269 (2012).
9. West, A. E. et al. : Handb. Exp. Pharmacol., 220, 67 (2014).
10. Deinhardt, K. and Chao, M. V. : Neuropharmacology, 76, 603 (2014).
11. Numakawa, T. et al. : Histol. Histopathol., 25, 237 (2010).
12. Zagrebelsky, M. and Korte, M. : Neuropharmacology, 76, 628 (2014).
13. Choo, M. et al. : Nat. Commun., 8, 195 (2017).
14. Jones, K. R. et al. : Cell, 76, 989 (1994).
15. Cunha, C. et al. : Front. Mol. Neurosci., 3, 1 (2010).
16. Cohen-Cory, S. et al. : Dev. Neurobiol., 70, 271 (2010).
17. Harward, S. C. et al. : Nature, 538, 99 (2016).
18. Horch, H. W. et al. : Neuron, 23, 353 (1999).
19. Horch, H. W. and Katz, L. C. : Nat. Neurosci., 5, 1177 (2002).
20. Itami, C. et al. : J. Neurosci., 27, 2241 (2007).
21. Kimura, F. and Itami, C. : J. Neurosci., 39, 3784 (2019).
22. Xenos, D. et al. : Cereb. Cortex, 28, 3399 (2018).
23. Lu, Y. et al. : Neurobiol. Learn. Mem., 89, 312 (2008).
24. Miao, Z. et al. : Int. J. Mol. Sci., 21, 1375 (2020).
25. Duffy, H. B. D. and Roth, T. : Front. Hum. Neurosci., 14, 594244 (2020).
26. Skogstrand, K. et al. : Transl. Psychiatry, 9, 252 (2019).
27. Galvez-Contreras, A. Y. et al. : Front. Psychiatry, 8, 126 (2017).
点击此处查看相关产品介绍页面
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |