阐明BDNF-从基础到临床-
![]()
赫尔辛基大学 神经科学中心 梅森十三
◆前言
此前,我们阐述了BDNF通路与神经可塑性的控制相关。如果可塑性提高,为适应学习以及环境的变化,神经回路会进行结构以及功能上的重组。据病理生理学的(前)临床研究报告,精神分裂症和抑郁症等精神疾病患者身上发现了通过BDNF及其受体TrkB介导的信号传导异常。最近,研究人员还阐明了抗抑郁药通过BDNF/TrkB信号传导来调节神经可塑性的机制。本文将结合最新的研究结果,讲解BDNF/TrkB通路异常与精神疾病的关系,以及以该通路为靶标的精神疾病症状的改善。
◆精神分裂症中的BDNF/TrkB通路异常
BDNF通路不仅在胚胎期和临界期的大脑发育中发挥作用,在成年的海马体以及大脑皮层神经细胞的可塑性和生存调节中也发挥重要作用。因此,BDNF通路的异常可能与精神分裂症患者的大脑变化相关。实际上,在精神分裂症的动物模型中确实发现了BDNF的失调,TrkB前脑特异性敲除小鼠也出现了类似精神分裂症的行为,如异常多动、刻板行为以及认知功能障碍等。
另外,据精神分裂症患者死后的大脑分析报告称,虽然在大脑皮层区域以及海马体中BDNF的浓度下降,但在前扣带回中BDNF的浓度呈上升状态。研究人员推测,这些BDNF的表达异常可能导致了精神分裂症患者的神经发育和神经可塑性的异常1-3)。
◆情绪障碍中的BDNF/TrkB信号传导异常
研究表明,在自杀者和重度抑郁症患者死后的大脑中,BDNF的mRNA和蛋白的数量有所减少,尤其是在海马体和小脑扁桃体中更为明显4)。另外,在抑郁症患者和自杀者的外周血单个核细胞中,BDNF基因启动子的DNA甲基化也有所增加,推测为BDNF表达的不完全调节5)。
在本连载系列的第二回中,提到了人血清中可能来源于血小板的BDNF,检测出高水平。有趣的是,抑郁症患者血清或血浆BDNF的水平较低,但使用抗抑郁药物治疗成功后又会恢复到原有水平。另外,与成功治愈的抑郁症患者以及健康组相比,未经过治疗的抑郁症患者的血清BDNF水平也显著下降4,6)。
与健康组相比,BDNF和proBDNF的比率在双向情感障碍中较高,在抑郁症中较低,由此,其有望作为区分两者的标记物7,8)。但这些BDNF水平如上文所述,在精神分裂症1,3)中呈下降趋势,而在自闭症中则显示上升和下降两种情况9)。由于血清BDNF含量在个体间以及个体内存在高度差异,其可信度和疾病特异性还需进一步探讨。
在抑郁症患者死后的大脑中,除了BDNF,TrkB的蛋白以及mRNA的水平也有所下降,且有报告称TrkB的基因突变与自杀相关。此外,研究人员发现在抑郁症患者的大脑样本中,处于激活状态的磷酸化TrkB数量也有所减少4)。
◆BDNF和精神疾病的遗传相关
BNDF的第66号氨基酸残基大部分为缬氨酸,但此位置上,Caucasoid(高加索人种)的20%~50%为蛋氨酸(Val66Met多态性)10,11)。研究人员认为,此多态性并不只是抑郁症和精神分裂症等精神疾病的风险因素,也可能是多发性硬化症、阿尔茨海默病、帕金森病等神经退行性疾病的风险因素12,13)。
有报告称,在抑郁症中,这种多态性与儿童期虐待、贫困和成年期慢性压力导致的抑郁症易感性有关14)。在动物实验中,此多态性会影响空间记忆和焦虑性行为,以及细胞内BDNF的运输和神经活动依赖性BDNF的释放10,15),还会损伤BDNF mRNA的树突运输16),并降低长时程抑制(long-term depression : LTD)17)。也就是说,此多态性可能会影响BDNF活动依赖性的神经可塑性。
◆抗抑郁药物通过BDNF/TrkB信号提高可塑性
鉴于BDNF/TrkB信号传导在抑郁症患者的血液以及大脑中不断减少,所以抗抑郁药物能提高BDNF水平的这一发现非常重要。实际上,在动物实验中已经发现三环类的单胺氧化酶抑制剂以及选择性血清再摄取抑制剂(Serotonin selective reuptake inhibitor : SSRI)的抗抑郁药能够提高大脑中的BDNF表达水平6)。
另外,小鼠海马的齿状回细胞BDNF和齿状回颗粒神经元前体细胞TrkB的表达缺失,会降低抗抑郁药对抑郁行为和神经发生的效果6)。近年来,即使是作为速效性抗抑郁药物备受瞩目的麻醉药氯胺酮(NMDA型谷氨酸受体拮抗剂),也会由于小鼠前脑区域的BDNF或TrkB的基因缺失,而导致其减少抑郁样行为和增强海马突触等抗抑郁效果受到抑制18)。
此外,Val66Met多态性的小鼠模型,已丧失抗抑郁药物对行为以及神经可塑性的相关反应15,19)。而且在这些小鼠中,由氯胺酮和其代谢物(2R、6R)-羟基化去甲基氯胺酮(hydroxynorketamine ; HNK)所诱导的树突棘形成的增加也受到了抑制18,20)。HNK在氯胺酮的抗抑郁疗效中起主导作用,并且通过BDNF/TrkB信号传导使神经可塑性发生变化21)。
然而,临床研究表明,Met等位基因可能可以改善传统抗抑郁药物的反应22-25),另一方面也有报告显示反应减少26)。要想阐明BDNF信号传导在抑郁症患者的抗抑郁反应中的作用,目前还需要更多的基因学分析依据4)。
◆幼年期可塑性诱导(iPlasticity)对于神经性精神疾病患者的症状改善
笔者所在的赫尔辛基大学神经营养因子研究室(Eero Castren教授),以长期给药抗抑郁药诱导幼儿期关键期样可塑性(induced juvenile critical period-like plasticity : iPlasticity)为焦点进行研究。Castren教授提出,此种可塑性的提高,在配合某种“锻炼”的情况下,不仅是抑郁症,或许也能应用于其他神经性精神疾病的治疗27)。
也就是说,长期给药大鼠或小鼠典型的SSRI药物氟西汀后,结合单眼遮蔽可改善弱视、结合恐惧记忆消除训练可改善创伤后应激障碍(PTSD),而且结合社会化训练还能改善攻击性28-31)。这是由于氟西汀通过激活BDNF/TrkB提高了神经可塑性,再加上内部与外部的刺激使神经激活,并引起脑神经网络重组。
但关于抗抑郁药物如何激活TrkB,又是哪一部分的神经网络受到了何种变化目前尚且不明。最近的研究显示,氟西汀、丙米嗪、氯胺酮等不同类别的抗抑郁药物能够直接与TrkB结合32)。形成二聚体的TrkB会在跨膜结构域互相交叉,形成一个能够与抗抑郁药物结合的口袋。抗抑郁药物能够与口袋内的胆固醇结合域直接结合,稳定突触膜的TrkB,并促进BDNF介导的TrkB信号传导32)。以上的发现提出了一个全新的假说,即抗抑郁药物的主要作用部位不是单胺转运体,而是直接与TrkB相结合。而这一假说同时也成为了热门话题。
而且,我们使用由光刺激引起的二聚化optoTrkB系统,进行了由于BDNF的扩散性而难以进行的靶细胞可塑性研究。小清蛋白阳性神经元通过与TrkB激活和单眼遮蔽结合,可唤起眼优势,提高突触可塑性、以及去抑制引起的LTP增加和脑电波同步33)。现在我们使用optoTrkB系统,以治疗PTSD、改善空间记忆能力和降低药物依赖性为目的进行研究。
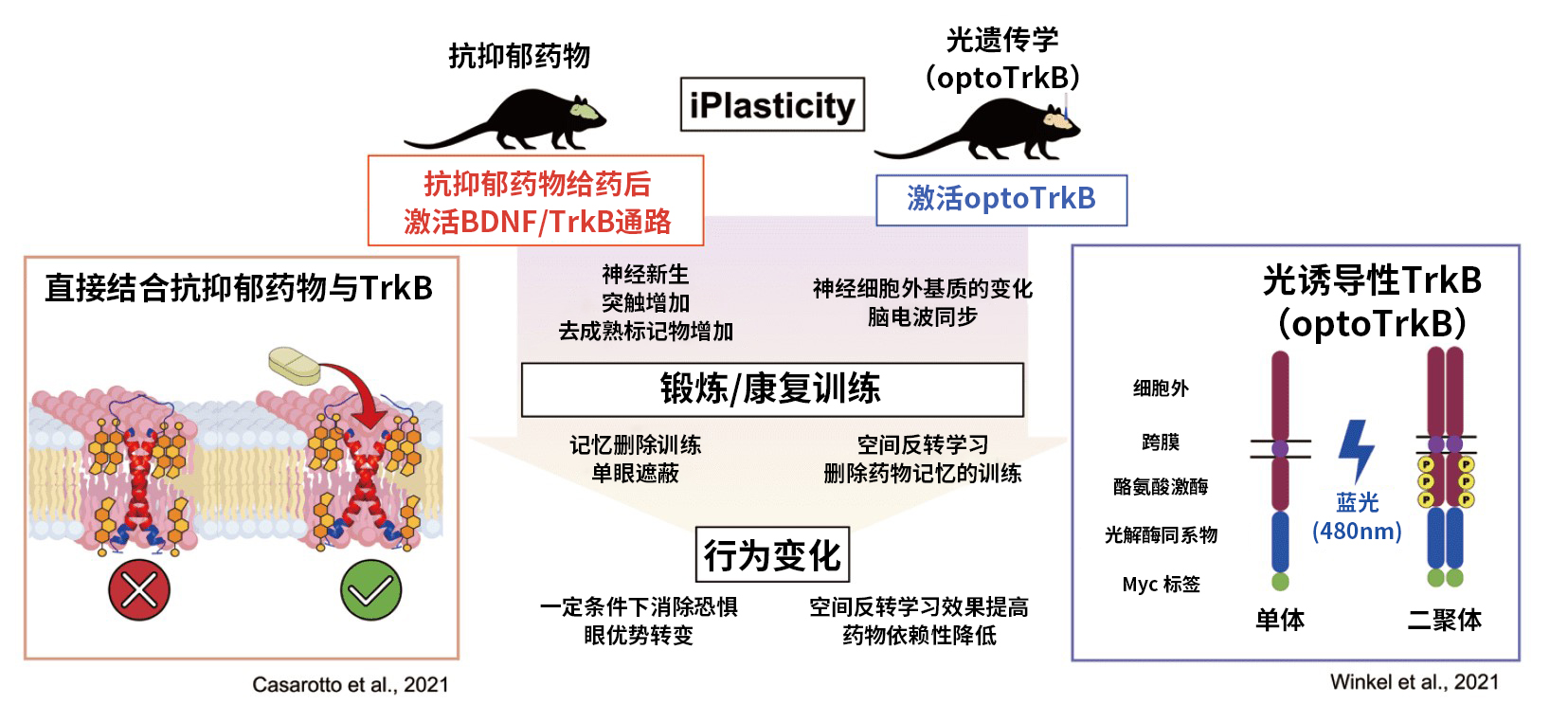
图:幼年期可塑性诱导(iPlasticity)引发的神经精神疾病患者的症状改善
◆结语
自发现Val66Met多态性以来,众多的基因研究表明,这种基因因素对抗抑郁药效果的影响存在差异。另一方面,也有部分研究表明其效果无法重现。这是由于不同的年龄、性别、环境因素、民族性、在分析时使用的基因模型、以及基因间的相互作用等多种因素混合,产生了复杂的影响而导致的结果34)。在使用动物模型的研究中,利用Val66Met多态性小鼠模型、抗抑郁药物作用的新模型和optoTrkB,有望阐明涉及BDNF通路的精神疾病的发病机制并发现全新的治疗方法。
◆致谢
感谢藤田医科大学 小清水老师提供的有益建言,谨在此表达由衷的谢意。
◆参考文献
1. Angelucci, F. et al. : Mol. Psychiatry, 10(4), 345 (2005). DOI: 10.1038/sj.mp.4001637
2. Fernandes, B. S. et al. : Mol. Psychiatry, 20, 1108 (2015). DOI: 10.1038/mp.2014.117
3. Nieto, R. R. et al. : Front. Psychiatry, 12, 662407 (2021). DOI: 10.3389/fpsyt.2021.662407
4. Castrén, E. and Monteggia, L. M. : Biol. Psychiatry, 90, 128 (2021). DOI: 10.1016/j.biopsych.2021.05.008
5. Hing, B. et al. : Am. J. Med. Genet. B Neuropsychiatr. Genet., 177, 143 (2018). DOI: 10.1002/ajmg.b.32616
6. Autry, A. E. and Monteggia, L. M. : Pharmacol. Rev., 64, 238 (2012). DOI: 10.1124/pr.111.005108
7. Yoshida, T. et al. : PLoS One, 7, e42676 (2012). DOI: 10.1371/journal.pone.0042676
8. Södersten, K. et al. : J. Affect. Disord., 160, 1 (2014). DOI: 10.1016/j.jad.2014.01.009
9. Saghazadeh, A. and Rezaei, N. : J. Autism Dev. Disord., 47, 1018 (2017). DOI: 10.1007/s10803-016-3024-x
10. Egan, M. F. et al. : Cell, 112, 257 (2003). DOI: 10.1016/s0092-8674(03)00035-7
11. Shimizu, E. et al. : Am. J. Med. Genet. B Neuropsychiatr. Genet., 126B, 122 (2004). DOI: 10.1002/ajmg.b.20118
12. Bath, K. G. and Lee, F. S. : Cogn. Affect. Behav. Neurosci., 6, 79 (2006). DOI: 10.3758/CABN.6.1.79
13. Shen, T. et al. : Aging Dis., 9, 523 (2018). DOI: 10.14336/AD.2017.0717
14. Hosang, G. M. et al. : BMC Med., 12 : 7, 1 (2014). DOI: 10.1186/1741-7015-12-7
15. Chen, Z.-Y. et al. : Science, 314, 140 (2006). doi: 10.1126/science.1129663
16. Baj, G. et al. : Front. Neurosci., 7, 188 (2013). DOI: 10.3389/fnins.2013.00188
17. Mizui, T. et al. : Proc. Natl. Acad. Sci. U. S. A., 112, E3067 (2015). DOI: 10.1073/pnas.1422336112
18. Björkholm, C. and Monteggia, L. M. : Neuropharmacology, 102, 72 (2016). DOI: 10.1016/j.neuropharm.2015.10.034
19. Bath, K. G. et al. : Neuropsychopharmacology, 37, 1297 (2012). DOI: 10.1038/npp.2011.318
20. Fukumoto, K. et al. : Proc. Natl. Acad. Sci . U. S. A., 116, 297 (2019). DOI: 10.1073/pnas.1814709116
21. Zanos, P. et al. : Nature, 533, 481 (2016). DOI: 10.1038/nature17998
22. Choi, M. J. et al. : Brain Res., 1118, 176 (2006). DOI: 10.1016/j.brainres.2006.08.012
23. Niitsu, T. et al. : Prog. Neuro-psychopharmacol. Biol. Psychiatry, 45, 183 (2013). DOI: 10.1016/j.pnpbp.2013.05.011
24. Yan, T. et al. : Asia-Pac. Psychiatry, 6, 241 (2014). DOI: 10.1111/appy.12148
25. Domschke, K. et al. : Int. J. Neuropsychopharmacol., 13, 93 (2010). DOI: 10.1017/S1461145709000030
26. Laje, G. et al. : Biol. Psychiatry, 72, e27 (2012). DOI: 10.1016/j.biopsych.2012.05.031
27. Castrén, E. : Nat. Rev. Neurosci., 6, 241 (2005). DOI: 10.1038/nrn1629
28. Umemori, J. et al. : Psychiatry Clin. Neurosci., 72, 633 (2018). DOI: 10.1111/pcn.12683
29. Mikics, É. et al. : Neuropsychopharmacology, 43, 235 (2017). DOI: 10.1038/npp.2017.142
30. Karpova, N. N. et al. : Science, 334, 1731 (2011). DOI: 10.1126/science.1214592
31. Vetencourt, J. F. M. et al. : Science, 320, 385 (2008). DOI: 10.1126/science.1150516
32. Casarotto, P. C. et al. : Cell (2021). doi: 10.1016/j.cell.2021.01.034.
33. Winkel, F. et al. : Mol. Psychiatry, 1-10 (2021). doi: 10.1038/s41380-021-01211-0.
34. Tsai, S.-J. et al. : Front. Mol. Neurosci., 11, 156 (2018). doi: 10.3389/fnmol.2018.00156
点击此处查看相关产品:Mature BDNF ELISA试剂盒 Wako
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |