
Christian R. Good; Alistair White; Joao Brandao; Simon Jackson

◆摘要
目前用于检测水体粪便污染的方法依赖于粪便污染指示菌(FIB,大肠杆菌和肠球菌)的培养,该方法需要24~48 h,或导致预防措施的延迟,并对公共卫生构成威胁。因此,我们需要更快速的检测方法。在本研究中,我们测试了一种快速便携的检测方法——Bacterisk。该方法可在30 min内检测出细菌生物标志物内毒素,从而定量检测水样中的细菌生物量。我们同时评估了159个沿海水样,并将结果与传统的FIB培养进行比较。
Bacterisk检测法的内毒素风险(ER,Endotoxin Risk)数据与FIB培养结果之间存在明显的相关性,根据欧盟浴场水质指令的数值能准确区分劣质、良好和优质的浴场用水。根据受试者工作特性曲线(ROC)确定适用于沿海水样检测的最优 ER阈值,曲线下面积为0.9176,p值为0.0001。最优阈值为7,300 ER单位,灵敏度为95.45%,特异性为 83.48%。结果显示,Bacterisk检测法是一种快速、易用的原位评估浴场用水水质的方法。
本文亮点
l 分析了多份沿海水样
l 使用了新开发的水质快速评估方法(Bacterisk)
l Bacterisk检测法的结果与传统培养方法显示高相关性
l Bacterisk检测法提供了一种可快速评估海水浴场水质的方案
关键词:Bacterisk、海水浴场水质、内毒素、粪便指示菌、公共卫生、快速方法
◆引言
水上娱乐活动对身心健康至关重要(Overbury et al. 2023),此类活动带来的旅游效应也为当地经济带来了巨大收益。欧洲人每年在开放水域上娱乐旅游的花费超8000亿欧元(Börger et al. 2021)。但不幸的是,污水排放和农业径流等各种来源的微生物污染对公众健康构成重大威胁。与不游泳的人相比,游泳者出现胃肠道疾病、呼吸道感染、皮肤感染、耳部和眼部感染等症状的风险要高出3.3倍(Leonard et al. 2020),与废水相关的抗微生物耐药性的增加也进一步加剧了感染风险(Fouz et al. 2020)。此外,水质是游客选择旅游目的地的主要原因((Dodds & Holmes 2018),水质不佳的印象可能会导致欧洲每年损失约1000亿欧元的收入(Börger et al. 2021)。 因此,监测海水浴场水质对于降低娱乐用水的健康风险、改善公众对水质的印象和信心至关重要。
利用粪便指示菌(FIB)可监测沿海水质是否受到粪便污染,最常用的指示菌是大肠杆菌和肠球菌。这些细菌一般存在于包括人类在内的温血动物的肠道中,而当这些细菌出现在水中时,就表明水质受到了粪便污染。大多数FIB并不致病,但它们能证明水中存在粪便污染,这可能是沙门氏菌、志贺氏菌、梭菌、军团菌、耶尔森氏菌、结核杆菌、腺病毒、诺如病毒、轮状病毒和冠状病毒(Motlagh & Yang 2019)、寄生虫和真菌物种(Shah et al. 2011)等致病菌的潜在来源。使用FIB作为其他潜在危害性更大的病原体的替代物,无需进行多次检测,从而节省了资源。
欧盟目前通过监测大肠杆菌和肠道肠球菌(《浴场水质指令》,BWD,2006/7/EC)对浴场用水水质进行监管,并根据水域中这些指标细菌的含量(表1),每年将水域划分为 “优秀”、“良好”、“合格”或 “不合格”四级(Bathing Water Regulations 2013)。
表1
沿海和过渡水域标准
参数(CFU/100 mL) | 优秀( a ) | 良好 ( a ) | 合格 ( b ) |
Intestinal Enterococci 肠道肠球菌 | 100 | 200 | 185 |
Escherichia coli 大肠杆菌 | 250 | 500 | 500 |
a:基于95百分位数
b:基于90百分位数
基于培养的FIB计数方法是目前的金标准,自20世纪中期起一直使用至今(Dufour 2021)。虽然这些方法已经非常成熟,但它们也有几个主要缺点。最显著的问题是,这些方法需要至少18~44 h的时间来培养微生物,这意味着获得的任何结果具有滞后性,无法及时采取措施来解决有关污染水域的问题。此外,目前的方法需要将样本运送到专门的实验室,还需要专业人员使用可重复的方法来进行操作。由于只聚焦于FIB,可能无法检测出其他不一定属于粪便性质的病原体(Topić et al. 2021)。目前的方法存在的缺点证明,我们不仅需要更快速的解决方案,还需要更全面的解决方案,以便指示更多的病原体。
一些研究人员认为,内毒素可能是快速确定细菌生物量和水质的有效生物标志物(Jorgensen et al. 1973; Watson et al. 1977; Evans et al. 1978; Jorgensen et al. 1979; Haas et al. 1983)。内毒素是存在于革兰氏阴性菌和某些蓝藻外膜中的脂多糖,我们团队之前的研究表明,由于天然肠道微生物群和污水排放(Sattar et al. 2013)中存在高浓度的革兰氏阴性菌(尤其是大肠菌群),所以可使用内毒素作为海水(Sattar et al. 2013)和地表水(Sattar et al. 2022)的粪便污染标志物。Molendotech团队开发了一种便携式实时检测水中内毒素的试剂盒(Bacterisk),即使是非专业人员也可以在现场进行操作。
本研究旨在评估Bacterisk检测法作为快速风险评估工具的性能,以评估英格兰西南部沿海和内陆浴场水域的水质。为此,我们同时使用传统的培养方法和Bacterisk方法检测FIB、大肠杆菌和肠道肠球菌。
◆所需材料和方法
采集水样
根据《Bathing Water Regulations》(2013年),我们在英格兰西南部的不同地点共采集了 159 份沿海和过渡水域样本。使用无菌瓶在水面下30 cm、至少1 m深的水中采集500 mL样品,避光运输,并在4 h内进行检测;或将样品储存在冰箱中(2-8 ℃),并在采集后24 h内进行检测。
膜过滤
使用6分支真空滤膜架(Sartorius, UK),通过0.45 μm滤膜(Whatman, UK)对每种水样(1、10 和100 mL)进行无菌过滤。将滤膜置于膜乳糖葡萄糖醛酸琼脂(MLGA)(Oxoid, UK)上,在30 ℃下培养4 h后,再在37 ℃下培养14 h,以检测推定的大肠杆菌;或置于Slanetz和Bartley培养基(Oxoid,UK)上,在36 ℃下培养44 h,以检测推定的肠道肠球菌。然后计算菌落形成单位(CFU)的数量,并以CFU/100 mL表示。
细菌检测
按照厂家的说明进行Bacterisk检测(Molendotech Ltd, Brixham, UK; www.bacterisk.com)。以 1:100 的比例在缓冲液中稀释样品,然后与等体积的检测试剂在无内毒素的微量比色皿中混合,最终体积为200 μL。随后使用集成的Bacterisk孵育器和读数器,样品在37 ℃下孵育25 min,根据样品在405 nm处检测吸光度计算内毒素风险(ER)评分。部分样品可使用Biotek ELx808酶标仪(Agilent)进行孵育和读数,以提高通量。每次检测都需要设置一个阴性对照(无内毒素水)和一个阳性对照(大肠杆菌055:B5的内毒素)。
凝胶法检测
按照制造商提供的说明书,通过动态显色鲎试剂(LAL)法检测内毒素活性(EU/mL)。
统计分析
使用 GraphPad Prism Ver.9(Windows版)、GraphPad Software, Boston, Massachusetts, USA(www.graphpad.com)通过Fisher精确检验和卡方检验对样品分布以及Bacterisk检测法数据与培养水质之间的相关性进行统计分析。
结果
Bacterisk检测法通过测定样本中内毒素浓度,将其量化为内毒素风险单位(ER)——该单位为基于终点法试剂颜色变化的相对标度。如前所述 (Sattar et al. 2022),ER与使用动力学鲎试剂 (LAL) 检测法测定的内毒素活性 (EU/mL) 直接相关,当ER达到10,000 时,Bacterisk检测法开始饱和并失去线性关系 (图1)。
图1
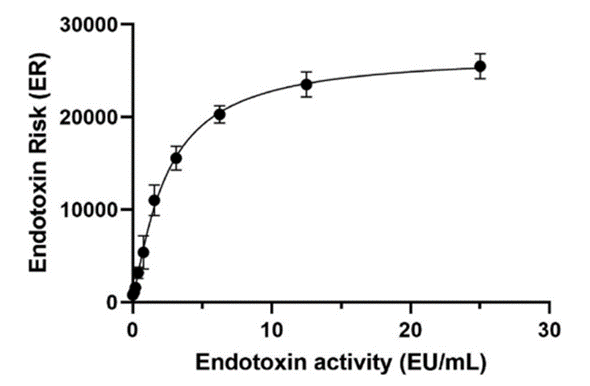
四参数拟合的标准曲线显示内毒素活性(EU/mL)与ER之间的相关性。R² = 0.9892。每个点代表三次独立实验的平均值±平均值的标准误差。
本次共对159个沿海及过渡区水样同时进行分析,使用Bacterisk检测法计算ER,并使用膜过滤法计算大肠杆菌和肠道球菌(CFU/100 mL)的含量。根据大肠杆菌(CFU/100 mL)含量,将样品进一步分为“良好/合格”和“不合格”两组水质。根据《浴场水质指令》,BWD,2006/7/EC,水质“不合格”的阈值设定为>500个大肠杆菌CFU/100 mL。根据此阈值,共计有107个“良好或合格”的样品,其ER中值为3,696,25和75百分位数分别为2,219和6,108;另有52个“不合格”样本,ER中值为12,475,25和75百分位数分别为8,827和20,316。虽然肠道球菌也被视作FIB,但由于它们是革兰氏阳性菌,所以并非用于对水样进行分类,而是用于了解肠道球菌与ER之间是否存在相关性。
虽然Bacterisk的检测结果可用于获得区分不同水质水平的风险组,但在此我们将其用作二元分类模型,以确定水源是被污染的(“不合格”)还是清洁的(“良好或合格”)。检查此类模型性能的最有效方法之一是绘制受试者工作特性曲线(ROC),然后利用该曲线确定用于区分两组水质的最佳阈值ER值。以1-特异性作为x轴,计算公式如下:
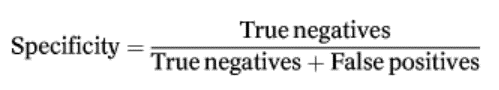
以灵敏度(真阳性)为y轴,计算公式如下:

通过绘制每个Bacterisk值的点,ROC曲线可以直观地区分Bacterisk检测法整个结果范围内的清洁样品和污染样品,该方法将每个结果视为一个具有其灵敏度和特异性的唯一阈值,然后通过选择Youden指数最高的阈值来确定最佳阈值。Youden指数是衡量整体诊断有效性的统计数据(Youden 1950),计算公式如下:

通过ROC曲线可计算出一个介于0和1之间的曲线下面积值(AUC值)。AUC值越接近1,模型在预测正确分类方面的性能越好。而AUC值为0.5表示模型没有预测正确分类的能力,AUC值大于0.8的模型被认为是可接受的(Nahm 2022)。ROC分析确定AUC值为0.9176,p值小于0.0001(图2)。Youden指数分析确定阈值≥7,300(Youden 指数=0.7893),对应于95.45%的灵敏度和 83.48%的特异性。
图2
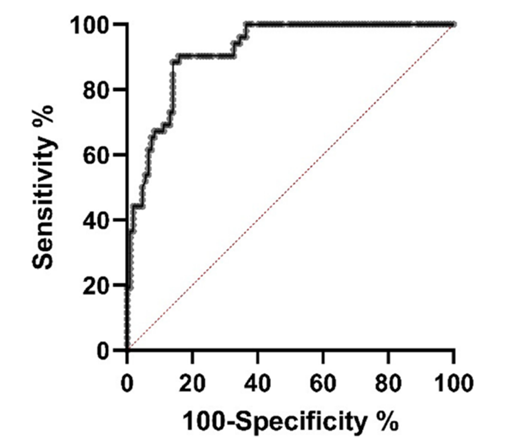
Bacterisk检测法判别沿海和过渡区水样中是否存在污染的ROC 曲线(AUC = 0.9176,Youden指数 = 0.7893)。AUC 为ROC曲线下面积。
在确定Bacterisk检测法检测的灵敏度和特异性后,根据水样的ER结果与大肠杆菌和肠球菌培养结果作图。使用欧盟指令中规定的大肠杆菌阈值(>500 CFU/100 mL)来区分“良好或合格”的浴场水质与“不合格”的浴场水质,获得了 Bacterisk检测法结果与大肠杆菌结果之间的相关性,肠球菌也获得了相同的相关性(图3)。将ER阈值(≥7,300 ER)和FIB阈值(肠球菌 >200 CFU/100 mL)应用于图3,可以绘制一个象限,并将结果区分为真阳性 (TP) 和真阴性 (TN)。此外,Bacterisk检测法检测结果为“阳性”但培养结果为阴性的样本,会被标记为“脱靶阳性”(OP),这是由于存在其他革兰氏阴性菌或潜在可存活但不可培养细菌(VBNC)产生的高浓度内毒素所致;而Bacterisk检测法检测结果为阴性但培养结果为阳性的样本,会被标记为“假阴性”(FN)。在44份培养阳性样本中,有两份被Bacterisk检测法检测为阴性,假阴性率为4.5%(相比之下,Colilert-18® 的假阴性率为7.4% (Tiwari et al. 2016),计算公式如下:

图3
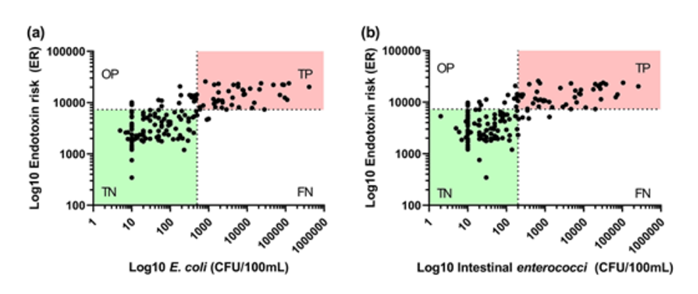
散点图显示了使用膜过滤法计数的Bacterisk ER对 (a) 大肠杆菌和 (b) 肠道肠球菌的检测结果。该图根据ER阈值(X 轴 7,300)以及 (a) 大肠杆菌阈值(Y 轴 >500 CFU/100 mL)和 (b) 肠球菌阈值(Y 轴 >200 CFU/100 mL)分为四个象限。N=159;TN:true negative(真阴性);TP:true positive(真阳性);FN:false negative(假阴性);OP:off-target positive(非目标阳性)。
在分析的 159 个水样中,Bacterisk ER结果与大肠杆菌和肠球菌培养结果之间有很强的一致性(TP 大肠杆菌=42;TP 肠球菌=46;TN 大肠杆菌=94;TN 肠球菌=91;OP 大肠杆菌=21;OP 肠球菌=17;FN 大肠杆菌=2,FN 肠球菌=5)。
根据ER阈值制作了列联表,并使用Fisher精确检验进行了分析,以检查样品的分布以及所选阈值与两类水质之间的相关性(表2),结果显示,ER取决于水质状况(p < 0.0001)。
表2
沿海和过渡水域阈值列联表
阈值 (ER) | 不合格 | 合格或良好 | 总计 |
<7,300 | 2 (1.26%) | 96 (60.38%) | 98 |
≥7,300 | 42 (26.42%) | 19 (11.95%) | 61 |
总计 | 44 | 115 | 159 |
不合格是指每100 mL样品中的大肠杆菌含量>500个,合格或良好是指每100 mL样品中的大肠杆菌含量≤500个。Fisher精确检验p值≤0.0001。
为了进一步提高水样在各个水质类别中的表征准确度,我们设置了三个风险组,并设定了不同的风险比阈值。根据水样被归类为“不合格”的可能性,这三个风险组分别被划分为低、中、高三个风险组,其中低风险组采用ROC分析确定的原始阈值。将三个风险组放入列联表(表3)中,并使用卡方检验进行趋势分析(X² = 88.93,自由度=1,p值≤0.0001。
表3
沿海和过渡水域风险组的列联表
风险组(ER) | 不合格 | 合格或良好 | 总计 |
低(<7,300) | 2 (1.26%) | 96 (60.38%) | 98 |
中(7,300–14,000) | 21 (13.21%) | 16 (10.06%) | 37 |
高(>14,000) | 21 (13.21%) | 3 (1.89%) | 24 |
总计 | 44 | 115 | 159 |
不合格是指每100 mL样品中的大肠杆菌含量>500个,合格或良好是指每100 mL样品中的大肠杆菌含量≤500个。趋势卡方检验 X²(1) = 88.93, p 值 <0.0001。
◆讨论
沿海水域的粪便污染会损害水质、加速传染病在人类和海洋生态系统之间传播,对健康构成严重威胁。沿海游泳者的患病率是非游泳者的3.3倍(Leonard et al. 2020),水质不佳的印象会对经济产生不利影响(Börger et al. 2021)。因此,有效监测粪便污染对于保护人类健康、防止或减轻粪便污染向海洋蔓延以及恢复公众信心至关重要。
目前,检测水体粪便污染的常规方法是检测指示菌:大肠杆菌和肠球菌。而检测需要将水样运送到符合标准的实验室,由专业人员对样品进行过滤、培养、生化检测和鉴定,通常需要18~44 h才能得到结果。因此,得到的结果具有滞后性,不利于针对污染水体采取积极主动的措施。虽然这种方法可以用于了解指定浴场在一段时间内的风险概况,但无法提供当前水质的信息。考虑到FIB的水平全天都在发生变化,常规方法具有很大的局限性(Kim et al. 2009)。
我们小组此前的研究表明,内毒素可作为海水(Sattar et al. 2013)和地表水(Sattar et al. 2022)粪便污染的标志物。Bacterisk检测法可检测细菌生物标志物内毒素,它的开发是为了解决目前基于培养的检测方法的局限性。此方法便于携带,可在30 min内得出结果,从而实现近乎实时的水质监测,有利于日常海滩管理决策收集信息。此外,它还可以在重大社会活动之前,通知公众水质是否适合游泳(WHO 2018)。
Bacterisk检测法通过“ER”单位来衡量内毒素含量,此单位与内毒素数量呈精确对应关系。本研究结果表明,Bacterisk检测法可有效监测沿海水质,且检测结果与FIB大肠杆菌和肠球菌的含量水平存在显著相关性。与肠球菌(一种不含有内毒素的革兰氏阳性菌)的显著相关性也令人意外,但很可能反映了同样存在于粪便污染中的革兰氏阴性菌的检测。ROC分析确定了沿海和过渡水样本的优化ER阈值为≥7,300,对应的灵敏度为95.45%,特异性为83.48%。使用该阈值,我们发现Bacterisk检测法ER值与大肠杆菌或肠球菌的存在具有显著相关性。在分析大肠杆菌时,60.38%的样本被归类为“良好或合格”,26.42%被归类为“不合格”。在所有样本中,11.95%的样本被Bacterisk检测法检测为阳性,但培养结果为阴性(“OP”)。这是由于Bacterisk检测法检测出了革兰氏阴性细菌产生的高水平内毒素,或处于VBNC状态的革兰氏阴性细菌。VBNC 细菌的问题会导致评估海水浴场水质时会明显低估活菌数量,产肠毒素大肠杆菌(Enterotoxigenic E. coli)在应激条件下会进入VBNC状态,但在海水和淡水中的长期培养后仍具有传染性(Lothigius et al. 2010)。因此,这种VBNC状态会对任何以大肠杆菌计数作为水质指标的检测方法的准确性产生负面影响。而Bacterisk检测法不仅能警示VBNC细菌的存在,还能检测其他潜在病原体,例如发现在当前指标检测方法中被归类为“良好”的游泳水中的沙门氏菌属(Mansilha et al. 2010)等。同样,像嗜水气单胞菌属(Aeromonas ssp.)这样的病原体,其性质不一定是粪便性的。目前的方法无法直接检测或作为替代指标检测(Janda & Abbott 2010),但Bacterisk检测法可以通过检测其内毒素表达而检测到这些病原体(Magaña et al. 2013)。
内毒素也可能来源于非致病性细菌。然而数据显示,对于“良好或合格”类别,观察到中位数ER值为3,696,而“不合格”类别为12,475,其中位数和四分位数值分别为2,219和6,108,分别对应"良好或合格” 类别,而“不合格”类别的第25和第75百分位数值分别为8,827和20,316。这表明,在沿海和过渡性水域中检测到了来自革兰氏阴性菌的内毒素背景水平。我们观察到内毒素水平的显著增加仅发生在污染事件期间,而不是由正常微生物群落的波动导致。
在159份检测样品中,有2份经Bacterisk检测法检测为阴性,但经培养检测为阳性,假阴性率为4.5%。这些假阴性结果可能是由于表面活性剂、螯合剂或高浓度重金属离子的存在导致内毒素聚合体被破坏(Gorman & Golovanov 2022),从而导致了内毒素回收率低的现象。除极端情况外,Bacterisk检测法采用专门优化的100倍样品稀释以规避这一问题(Milton et al. 1992)。值得注意的是,目前的标准方法Colilert-18®在测试芬兰的浴场水域时显示其假阴性率为7.3%(Tiwari et al. 2016),因此Bacterisk检测法的假阴性率更低。
值得一提的是,目前许多用于选择性分离和计数大肠杆菌的参考方法都依赖于检测β-D-葡糖醛酸酶,如发色性琼脂(MLGA、MI 和 Chromocult Coliform®)和Colilert®的不同配方(特别是Colilert-18®)。由于人类粪便中高达34%的大肠杆菌菌株(Chang et al. 1989)和从环境中分离的10-20%的大肠杆菌菌株(Shadix & Rice 1991)不含或仅含有较低水平的β-D-葡糖醛酸酶,因此依赖检测β-D-葡糖醛酸酶会导致假阴性率过高。此外,由于在本研究中使用MLGA来确定推定大肠杆菌的数量,因此被归类为 “OP ”的Bacterisk检测法结果实际上可能是真阳性。因此,由于所有大肠杆菌菌株无论其β-D-葡萄糖醛酸酶活性如何都能表达内毒素,因此可使用Bacterisk检测法进行检测。
◆结论
综上所述,已经证明Bacterisk检测法提供了一种快速、简便的原位评估海水水质的方法。Bacterisk检测法的检测结果与传统的FIB培养结果在统计学上具有明显相关性,这使我们有信心将Bacterisk检测法用作沿海海水水质的快速筛查工具。据估计,欧洲旅游业每年因水质差造成的损失约1000亿欧元,因此改善基础设施和检测对增强公众对浴场水质的信心至关重要。清洁的娱乐用水所带来的经济和健康价值,以及对污染企业创纪录的罚款,激发了人们对新型快速检测解决方案的需求,用于监测和评估海水浴场的风险。通过提供近乎实时的水质评估,Bacterisk检测法可让监管机构和负责浴场水质的公司能够立即采取行动,保护公众健康和环境。
◆参考文献
Bathing Water Regulations 2013 No. 1675. UK Government.
Börger, T., Campbell D., White, M. P., Elliott L. R., Fleming L. E., Garrett J. K., Hattam C., Hynes S, Lankia, T. & Taylor, T. 2021 The value of blue-space recreation and perceived water quality across Europe: A contingent behaviour study. Science of the Total Environment 771, 145597.
Chang, G. W., Brill, J. & Lum, R. 1989 PProportion of beta-D-glucuronidase-negative Escherichia coli in human fecal samples. Applied and Environmental Microbiology 55 (2), 335–339.
Dodds, R. & Holmes, M. R. 2018 Education and certification for beach management: Is there a difference between residents versus visitors? Ocean & Coastal Management 160, 124–132.
Dufour, A. 2021 A short history of methods used to measure bathing beach water quality. Journal of Microbiological Methods 181, 106134.
Evans, T. M., Schillinger , J. E. & Stuart, D. G. 1978 Rapid determination of bacteriological water quality by using Limulus lysate. Applied and Environmental Microbiology 35 (2), 376–382.
Fouz N., Pangesti, K. N. A., Yasir M., Al-Malki, A. L., Azhar E. I., Hill-Cawthorne G. A. & Abd El Ghany M. 2020 The contribution of wastewater to the transmission of antimicrobial resistance in the environment: Implications of mass gathering settings. Tropical Medicine and Infectious Disease 5 (1). doi: 10.3390/tropicalmed5010033.
Gorman, A. & Golovanov, A. P. 2022 Lipopolysaccharide structure and the phenomenon of low endotoxin recovery. European Journal of Pharmaceutics and Biopharmaceutics 180, 289–307.
Haas, C. N., Meyer, M. A., Paller, M. S. & Zapkin, M. A. 1983 The utility of endotoxins as a surrogate indicator in potable water microbiology. Water Research 17 (7), 803–807.
Holcomb, D. A. & Stewart, J. R. 2020 Microbial indicators of fecal pollution: Recent progress and challenges in assessing water quality. Current Environmental Health Reports 7 (3), 311–324.
Janda, J. M. & Abbott, S. L. 2010 The genus Aeromonas: taxonomy, pathogenicity, and infection. Clinical Microbiology Reviews 23 (1), 35–73.
Jorgensen, J. H., Carvajal H. F., Chipps, B. E. & Smith, R. F. 1973 Rapid detection of Gram-negative bacteriuria by use of the Limulus endotoxin assay. Applied Microbiology 26 (1), 38–42.
Jorgensen, J. H., Lee, J. C., Alexander, G. A. & Wolf, H. W. 1979 Comparison of Limulus assay, standard plate count, and total coliform count for microbiological assessment of renovated wastewater. Applied and Environmental Microbiology 37 (5), 928–931.
Kim, W. J., Managaki, S., Furumai, H. & Nakajima, F. 2009 Diurnal fluctuation of indicator microorganisms and intestinal viruses in combined sewer system. Water Science and Technology 60 (11), 2791–2801.
Leonard, A. F. C., Garside, R., Ukoumunne, O. C. & Gaze W. H. 2020 A cross-sectional study on the prevalence of illness in coastal bathers compared to non-bathers in England and Wales: Findings from the beach user health survey. Water Research 176, 115700.
Lothigius, A., Sjöling A., Svennerholm A. M. & Bölin I. 2010 Survival and gene expression of enterotoxigenic Escherichia coli during long-term incubation in sea water and freshwater. Journal of Applied Microbiology 108 (4), 1441–1449.
Magaña, J. T., Galbis, D. M., Montero, S. M. & Clusella, N. P. I. 2013 The lipopolysaccharide of Aeromonas spp: structure-activity relationships. Current Topics in Biochemical Research 15 (2), 41–56.
Mansilha, C. R., Coelho, C. A., Reinas, A., Moutinho, A., Ferreira, S., Pizarro, C. & Tavares, A. 2010 Salmonella: The forgotten pathogen: Health hazards of compliance with European bathing water legislation. Marine Pollution Bulletin 60 (6), 819–826.
Milton, D. K., Feldman, H. A., Neuberg, D. S., Bruckner, R. J. & Greaves, I. A. 1992 Environmental endotoxin measurement: The kinetic Limulus assay with resistant-parallel-line estimation. Environmental Research 57 (2), 212–230.
Motlagh, A. M. & Yang, Z. 2019 Detection and occurrence of indicator organisms and pathogens. Water Environment Research 91 (10), 1402–1408.
Nahm, F. S. 2022 Receiver operating characteristic curve: Overview and practical use for clinicians. Korean Journal of Anesthesiology 75 (1), 25–36.
Overbury, K., Conroy, B. W. & Marks, E. 2023 Swimming in nature: A scoping review of the mental health and wellbeing benefits of open water swimming. Journal of Environmental Psychology 90, 102073.
Sattar, A. A., Jackson, S. K. & Bradley, G. 2013 The potential of lipopolysaccharide as a real-time biomarker of bacterial contamination in marine bathing water. Journal of Water and Health 12 (1), 105–112.
Sattar, A. A., Good, C. R., Saletes, M., Brandão, J. & Jackson, S. K. 2022 Endotoxin as a marker for water quality. International Journal of Environmental Research and Public Health 19 (24), 16528.
Shadix, L. C. & Rice, E. W. 1991 Evaluation of beta-glucuronidase assay for the detection of Escherichia coli from environmental waters. Canadian Journal of Microbiology 37 (12), 908–911.
Shah, A. H., Abdelzaher, A. M., Phillips, M., Hernandez, R., Solo-Gabriele, H. M., Kish, J., Scorzetti, G., Fell, J. W., Diaz, M. R., Scott, T. M., Lukasik, J., Harwood, V. J., McQuaig, S., Sinigalliano, C. D., Gidley, M. L., Wanless, D., Ager, A., Lui, J., Stewart, J. R., Plano, L. R. & Fleming, L. E. 2011 Indicator microbes correlate with pathogenic bacteria, yeasts and helminthes in sand at a subtropical recreational beach site. Journal of Applied Microbiology 110 (6), 1571–1583.
Tiwari, A., Niemelä, S. I., Vepsäläinen, A., Rapala, J., Kalso, S. & Pitkänen, T. 2016 Comparison of Colilert-18 with miniaturised most probable number method for monitoring of Escherichia coli in bathing water. Journal of Water and Health 14 (1), 121–131.
Topić, N., Cenov, A., Jozić S., Glad, M., Mance, D., Lušić, D., Kapetanović, D., Mance, D. & Vukić Lušić, D. 2021 Staphylococcus aureus – An additional parameter of bathing water quality for crowded urban beaches. International Journal of Environmental Research and Public Health 18 (10), 5234.
Watson, S. W., Novitsky, T. J., Quinby, H. L. & Valois, F. W. 1977 Determination of bacterial number and biomass in the marine environment. Applied and Environmental Microbiology 33 (4), 940–946.
WHO 2018 WHO recommendations on scientific, analytical and epidemiological developments relevant to the parameters for bathing water quality in the bathing water directive (2006/7/EC) 2018. Geneva: Switzerland. Youden,
W. J. 1950 Index for rating diagnostic tests. Cancer 3 (1), 32–35.
点击此处查看相关产品页面:水质检测试剂盒BACTERISK
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |