
在实验中,我们通过输卵管壁将2细胞期胚胎移植入代孕小鼠体内。与传统胚胎移植的过程相比,更简易,而且适合没有经验的实验操作员。
◆材料
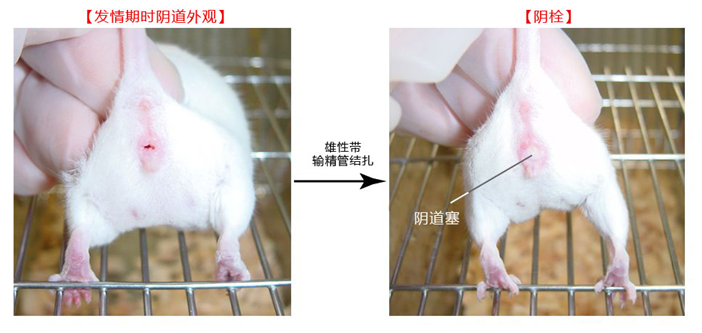
1. 假孕第一天的雌性小鼠(这天观察小鼠阴栓)
2. 微型弹簧剪刀(5mm刀片)
3. 钳子(Pair of watchmaker's #5 forceps)
4. 动脉夹
5. 伤口缝合器(Autoclip 9mm; Clay Adams 427631) 和clip applicator (Mik-Ron Autoclip Applier; Clay Adams 427630)
 →clip applicator
→clip applicator
6. 塑料培养皿 (35mm X 10mm Cat.No.430588; CORNING)
7. 用于胚胎的移植和操作的玻璃微管
◆步骤
准备小鼠
1. 麻醉一只雌性小鼠。
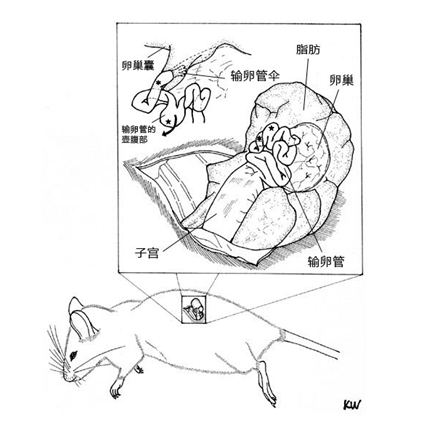
2. 常规方法是取出卵巢、输卵管及部分子宫。
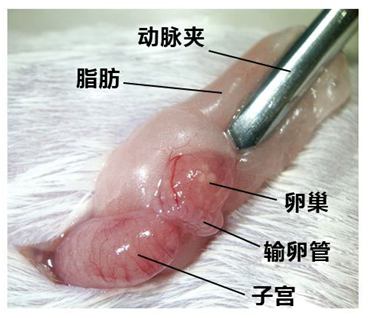
3. 用动脉夹固定附着在卵巢囊上的脂肪
定位输卵管
如下图所示,通过切割输卵管,往切口处插入微管,然后朝输卵管的壶腹部注入胚胎。
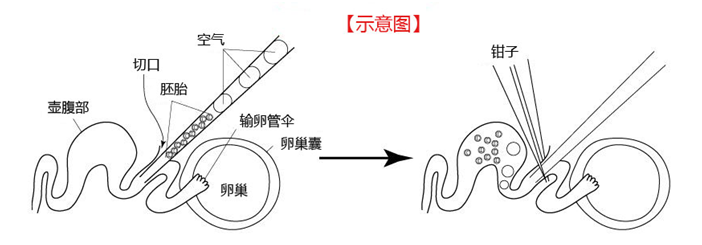
但是,正如我们所看到的输卵管的图示(A),小鼠的输卵管呈细微而复杂的折叠式结构。而且,微管是从上方插入的,胚胎难以到达输卵管的壶腹部。
为了简化此过程,在操作前,可以通过动脉夹来改变输卵管的定位,如图(B)。
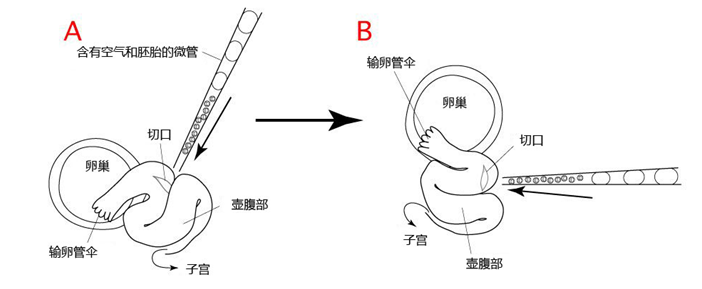
1. 立体显微镜下观察输卵管,并使用钳子的尖端来确认输卵管伞部和壶腹部的位置,或者改变动脉夹的位置。
2. 通过改变动脉夹和小鼠的位置来定位输卵管。
注意:因为每只小鼠的输卵管折叠形状都不一样,需要仔细观察和定位输卵管才能更容易地进行实验。
注意:如果你是左撇子,就能轻易地完成定位输卵管的步骤。
胚胎与玻璃微管的制备
1. 在培养皿上制作一个200μL的 KSOM/AA滴液 (无液体石蜡),然后在滴液里放入20个胚胎。
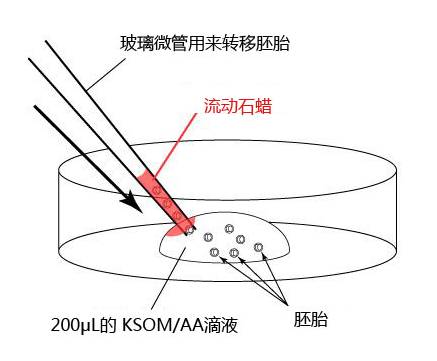
2. 制作转移胚胎的玻璃微管,管内的空气和溶液交替间隔2-3mm 。然后用玻璃微管吸入10个胚胎。
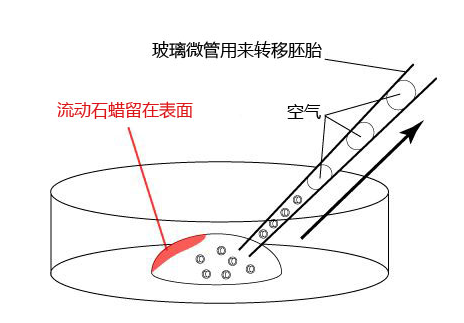
注意:如上图所示,当玻璃微管首次插入滴液时,液体石蜡会残留在滴液的表面。玻璃微管应从另一边吸入胚胎,以免吸入液体石蜡。
有证据表明,如果输卵管沾上液体石蜡会对胚胎发育造成不利的影响。

转移胚胎
1. 使用Pair of watchmaker's #5 forceps和微型弹簧剪刀,解剖伞部和壶腹部之间的输卵管壁。
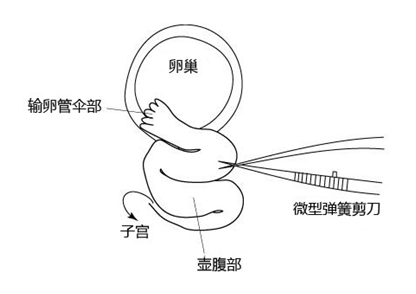
2. 将含有胚胎的微管插入输卵管的切口处,朝壶腹部注入胚胎。
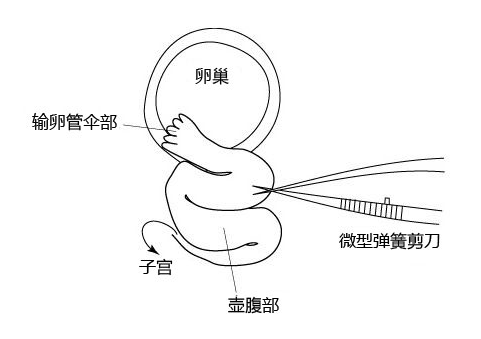
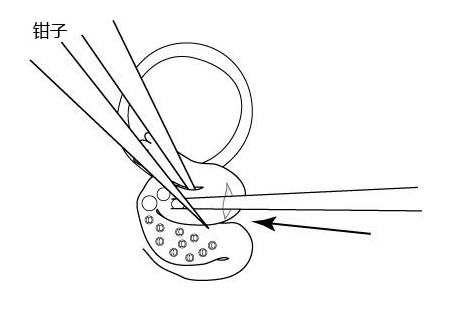
3. 用钳子固定微管插入的输卵管的位置。
4. 排出胚胎和2~3个气泡到壶腹部处。
注意: 如果实验进程顺利,你可以通过壶腹部的壁看到气泡。
注意:如果你无法将胚胎和气泡排进输卵管,稍微往后移动玻璃微管,再次尝试。
5. 将切口处的微管移走。
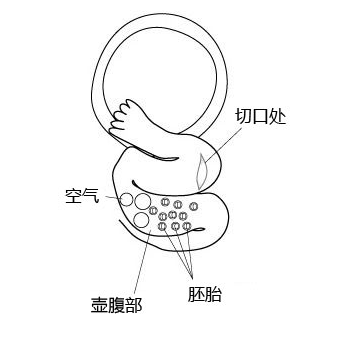
注意:调整输卵管的位置和方向后才能转移胚胎。如果微管平行对齐输卵管,就能更容易地插入输卵管内。
6. 把卵巢、输卵管和子宫放回小鼠的腹部,用伤口缝合器缝合伤口。

7. 重复上述步骤,把剩余的10个胚胎移植到另一只小鼠的输卵管内。
8. 在37°C 加热板上保持小鼠的体温,直到小鼠苏醒。
参考文献
【1】 Nakagata N. 1992. Embryo transfer through the wall of the fallopian tube in mice. Exp. Anim. 41: 387-388.
【2】 Nagy A., Gertsenstein M., Vintersten K., and Behringer R. 2003. Manipulating the Mouse Embryo, A Laboratory Manual (Third edition). Cold Spring Harbor Laboratory Press. ISBN 0-87969-591-9.
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |





 回到小鼠生殖工程学技术指南目录
回到小鼠生殖工程学技术指南目录