◆材料
1、 0.25 M 蔗糖
2、 KSOM/AA
3、 培养皿(Corning 35mm X 10mm Cat.No.430588)
4、 蓝色枪头(BM器材 Cat.No.111-R100S)
5、 微管
6、 自动移液器(GILSON PIPETMAN P-1000)
7、 解剖针(夏目制造所 Broach holder Cat.No.E-14)
8、 酒精灯(或者台式微型煤气燃烧器 Cat.No.RK4102)
9、 CO2培养箱(37°C 5% CO2 95% air)
◆步骤
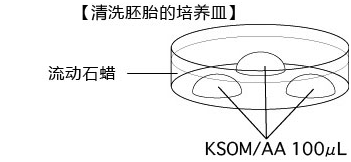
准备清洗胚胎用的培养皿和蔗糖溶液
1. 首先制作清洗复苏后胚胎的培养皿,静置在CO2培养箱内30分钟以上,稳定内部气体。
2. 预先在CO2培养箱内加热0.25 M 蔗糖溶液。
胚胎的复苏
1. 从液氮储存器内取出冻存的EP管后,立刻打开盖子,倒掉EP管内的液氮,在室温下静置30秒。
2. 用自动移液器把0.9ml已预热到37°C的0.25 M 蔗糖溶液添加进EP管内,在蔗糖溶液完全溶进冻存液前要迅速移液(10次左右)。
* 融解后的冻存液在常温下细胞毒性很强,因此需要迅速往EP管内添加0.25 M 蔗糖稀释冻存液。
移液
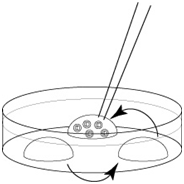
1. 如下图所示,首次移液需迅速把0.9mL 0.25 M 蔗糖溶液转移至EP管内加热(请注意如果枪头的尖端接触冻存液,枪头内的蔗糖溶液会冻结并阻塞在枪头的尖端)。
2. 第二次以后的移液,就按照下图蓝色箭头所示小幅度移液。
此外,第二次以后的移液,以免损坏胚胎,应小心且迅速有序地移液加热胚胎。(移液的速度请参考以下视频)
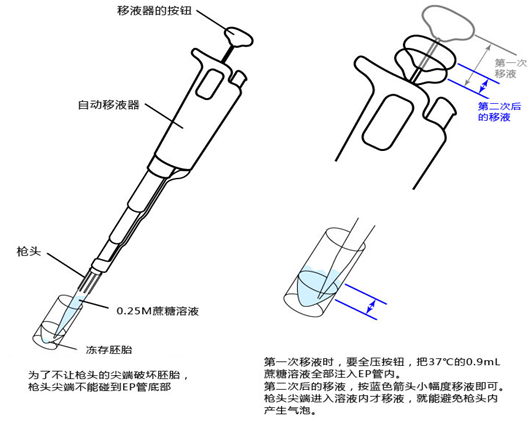
3. 使用自动给移液器,将冻存液和蔗糖溶液的混合溶液移至培养皿上,接着用0.4~0.5mL的0.25 M 蔗糖溶液清洗EP管。
注意:移液时,尽量避免产生气泡。在混合溶液移至培养皿上时,如果溶液表面产生气泡,气泡会阻碍取回胚胎,此时可用酒精灯加热解剖针的尖端,然后刺破气泡。
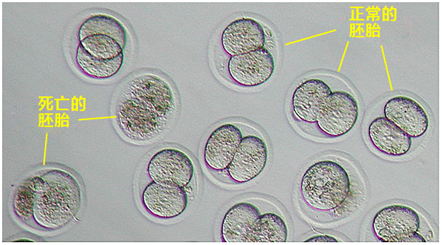
胚胎复苏时移液要点:请注意,移液过程中如果枪头内有气泡,混合溶液移至在培养皿后,溶液表面产生的大量气泡会导致难以在显微镜下观察胚胎,无法取回胚胎。
4. 直接从混合溶液里取出胚胎,小心地导入预先制作好(清洗前30分钟以上开始准备)、清洗胚胎的培养皿上的KSOM/AA滴液里,静置在培养箱内10分钟。
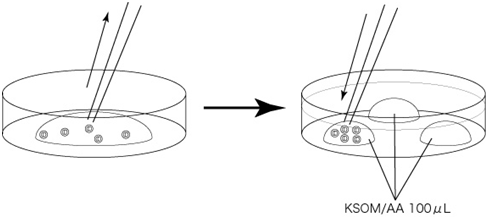
静置10分钟后
5. 用剩下的KSOM/AA滴液清洗胚胎两遍。
参考文献
【1】 Nakao K., Nakagata N., and Katsuki M. 1997. Simple and effcient procedure for cryopreservation of mouse embryos
by simple vitrification. Exp. Anim. 46: 231-234.PDF
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |





 回到小鼠生殖工程学技术指南目录
回到小鼠生殖工程学技术指南目录