USP微生物学专家委员会已批准将第<86>章节《使用重组试剂进行细菌内毒素检测》纳入美国药典国家处方集(USP–NF),该章节允许使用非动物源性试剂进行内毒素检测。<86>章节的最终文本将于2024 年11月发布,并于2025年5月正式生效。
<86>章提供了使用非动物源性试剂进行细菌内毒素检测的新方法,包括使用重组级联 (rCR) 和重组C因子(rFC)试剂,为生物制药制造商就如何将重组试剂纳入质量测试提供了必要的信息。
2021年2月5日,中国鲎、圆尾蝎鲎被列为国家二级保护野生动物。在天然鲎资源面临挑战的背景下,通过重组技术制备的重组C因子试剂(rFC)重组级联试剂(rCR)可不依赖天然鲎资源,实现可持续供应。
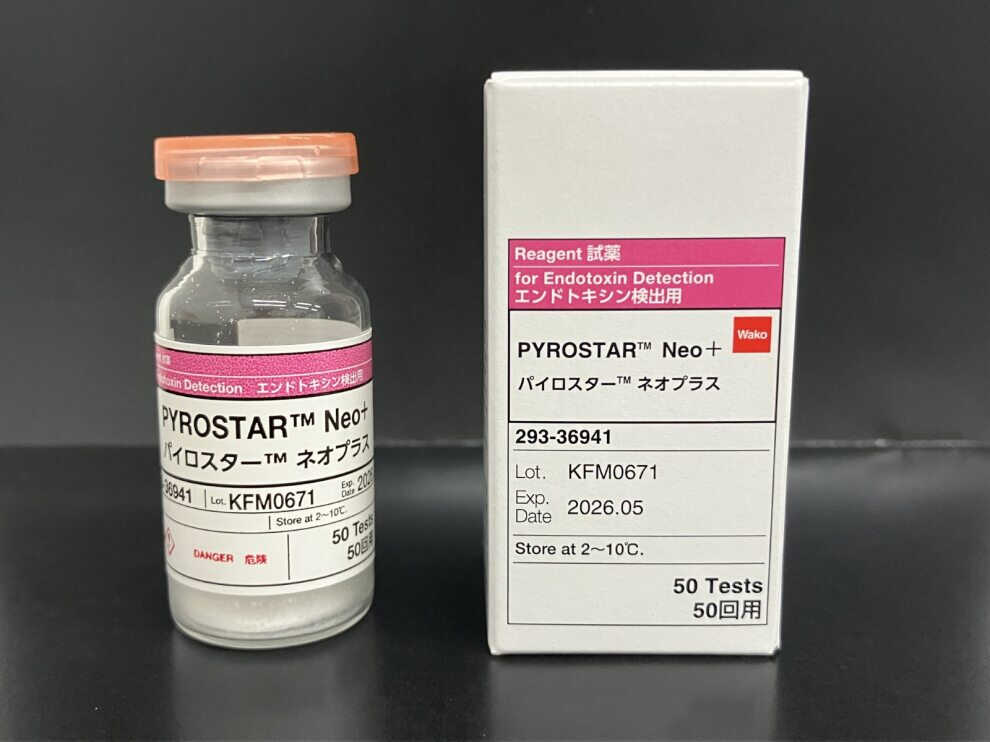
2024年7月,针对重组级联试剂法(rCR),FUJIFILM Wako推出细菌内毒素检测系列的新产品——PYROSTAR™ Neo+重组级联试剂(rCR)。
(点击图片了解更多)
◆特点
● 重组蛋白,批次间差异小
● 不含G因子,无(1→3)-β-D-葡聚糖假阳性风险
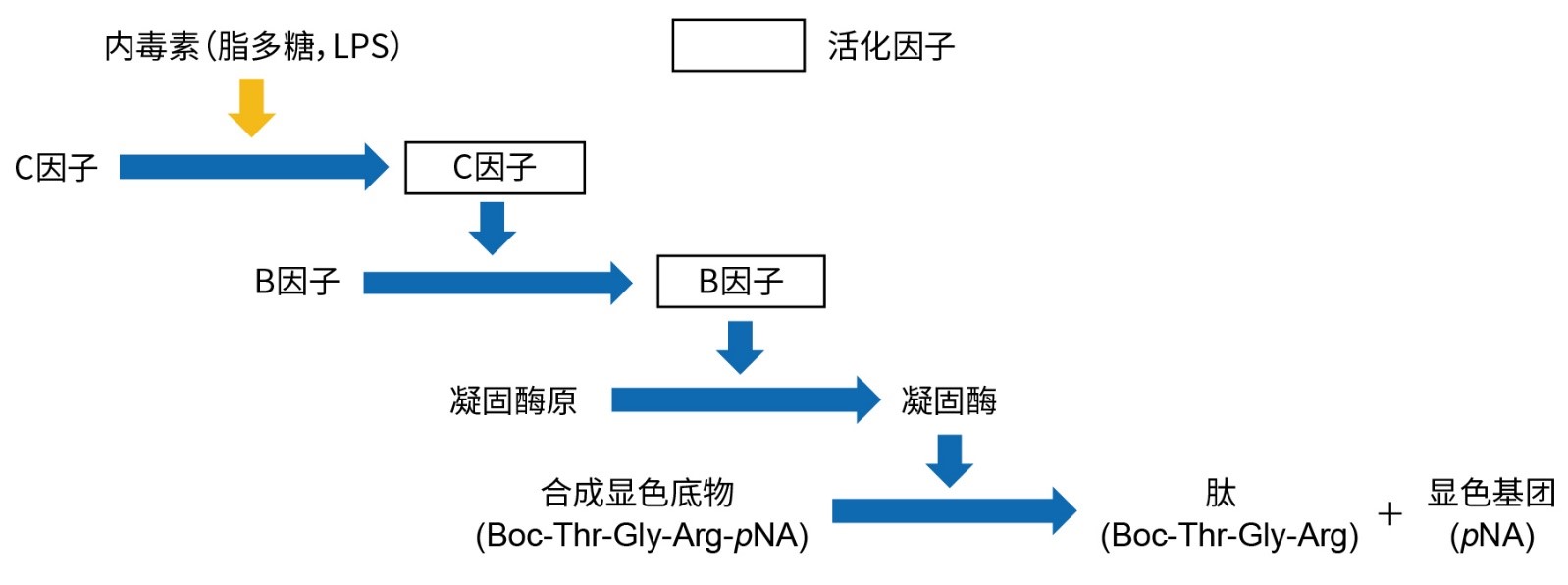
PYROATAR™ Neo+包含传统鲎试剂级联机制中的C因子、B因子及凝固酶原,但不含传统鲎试剂中的G因子,因此无(1→3)-β-D-葡聚糖假阳性风险。
● 动态显色法检测,兼容现有设备,无需更换荧光酶标仪

兼容现有设备及制备流程,可轻松实现从传统鲎试剂到重组级联试剂的转变。
● 定量范围广:0.001-50 EU/mL
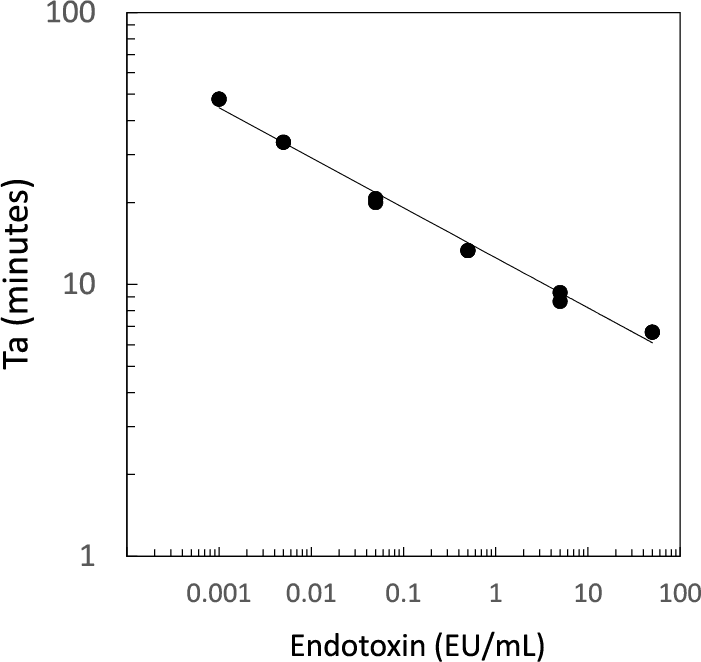
PYROATAR™ Neo+在0.001ー50 EU/mL的检测范围内存在良好的线性关系。
●与传统鲎试剂同等的反应性和再现性
对不同菌种来源脂多糖(LPS)的反应性
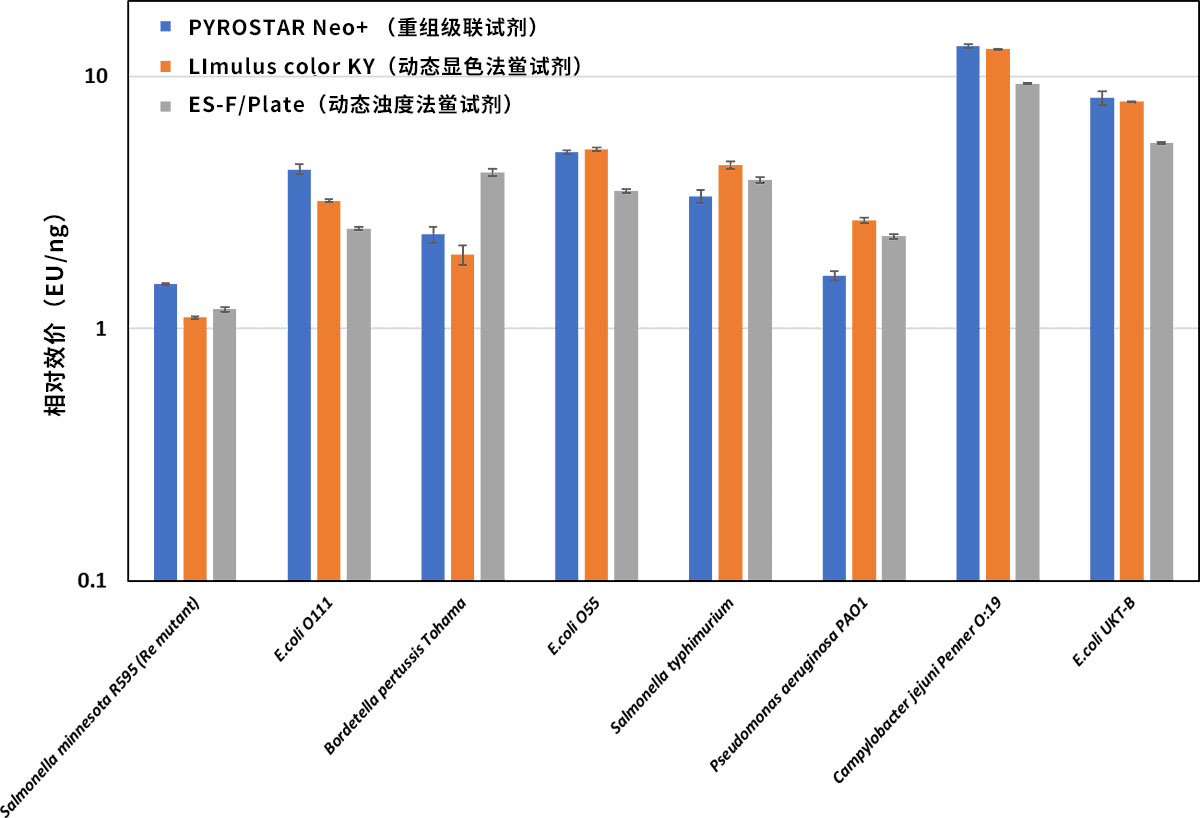
使用PYROATAR™ Neo+检测不同菌种来源的LPS与美国内毒素国家标准品(USP-RSE)的相对效价,结果与天然鲎试剂同等
对天然内毒素(Naturally Occurring Endotoxin : NOE)的反应性
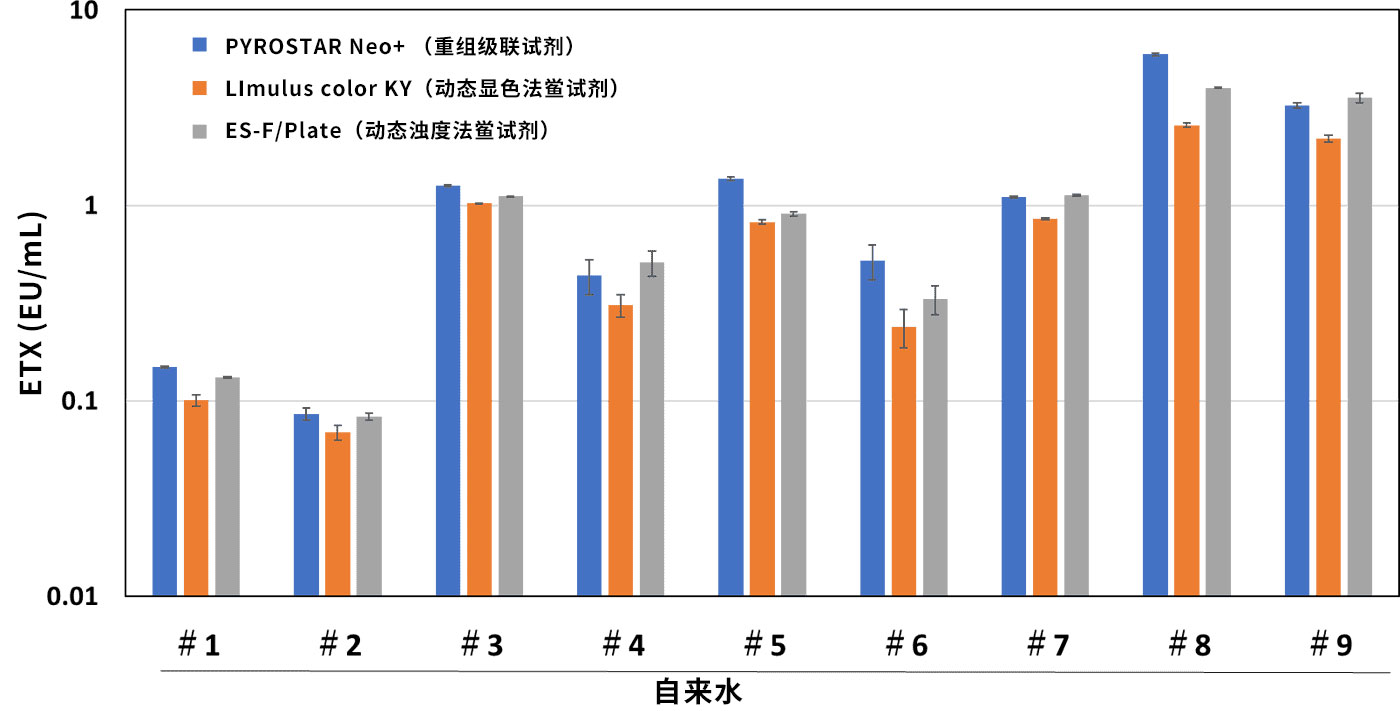
PYROATAR™ Neo+对NOE具有与天然鲎试剂同等的反应性。
不同药物检测的回收率
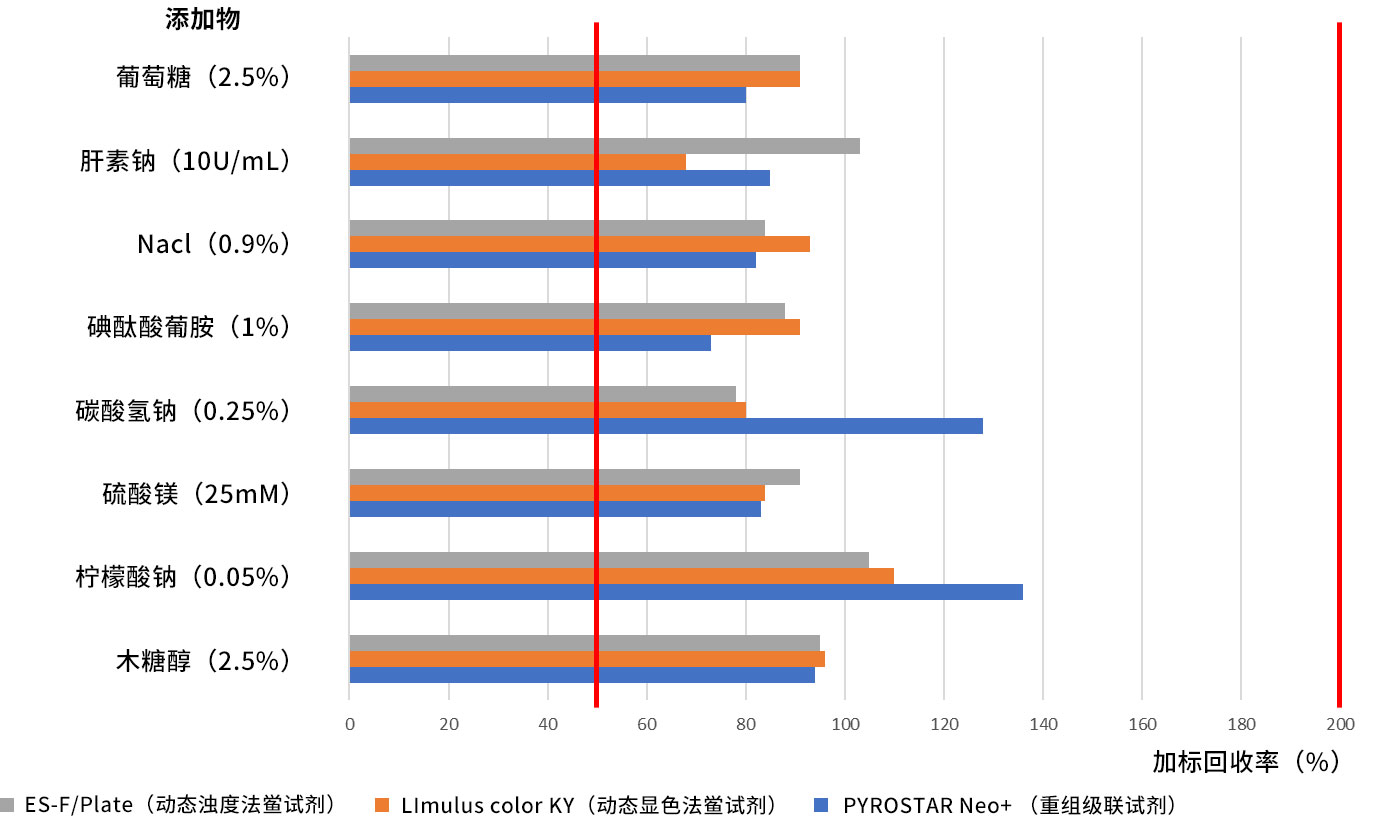
PYROATAR™ Neo+在不同药品的回收率, 与天然鲎试剂(LAL)有同等表现。
◆产品列表
产品编号 | 产品名称 | 产品规格 | 产品等级 |
293-36941 | PYROSTAR™ Neo+ | 50 tests | 内毒素检测用 |
点击此处查看产品页面:内毒素检测重组级联试剂 PYROSTAR™ Neo+
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |