![]()
大阪大学大学院医学系研究科消化器内科学 牧野祐紀、疋田隼人
◆前言
结缔组织生长因子(connective tissue growth factor ; CTGF/CCN2)是CCN(CCN1-6)蛋白家族中的一种细胞外基质蛋白。CTGF不仅会在各种细胞分泌的细胞外基质中与各种各样的分子进行相互作用,还会通过受体参与细胞间的信号传导,发挥细胞粘附、迁移、增殖、分化、细胞外基质蛋白的生成等生物学作用,并在生理性条件下参与器官的发育1)。在病理学上,结缔组织生长因子参与肺、心脏、肝脏和肾脏等各种器官的组织重塑2),是纤维化的核心介质,也有报道称其与各种肿瘤疾病的病理机制相关。
肝细胞癌是一种由肝炎病毒、酒精、脂肪肝等引起的慢性肝病所导致的恶性肿瘤,作为难治癌症,是日本的第五大癌症死因。众所周知,CTGF在肝细胞癌的癌组织中过度表达,CTGF可直接作用于癌细胞,促进DNA合成、细胞周期进展、浸润和迁移能力之外,也有报道称其还可以作用于肿瘤间质细胞,如促进癌症相关的成纤维细胞的增殖和巨噬细胞的迁移。然而,以上报告均为在in vitro进行的研究,CTGF在体内的意义尚不明确。CTGF是作用于细胞外基质蛋白的分子,为了解其作用,在活体水平(特别是癌症模型)中进行研究至关重要。因此我们使用肝脏多发癌症模型小鼠制备了细胞特异性CTGF缺陷肝癌模型,对CTGF在肝癌微环境病理发展中的意义3,4)。
◆Kras突变肝癌模型中CTGF和STAT3的激活
首先,使用肝细胞特异性Kras突变模型(Alb-Cre KrasG12D ; KrasG12D小鼠)作为癌症小鼠模型,并检测CTGF的表达。人肝细胞癌中的Kras基因突变十分罕见,但下游的Ras信号长期处于活化状态。本模型是假设由Ras通路的活化引起肝癌的模型,几乎所有个体都能使酷似人肝细胞癌的肝癌自然发病。此外,该模型的肝癌组织中不仅存在癌细胞,还存在肝星状细胞、血管内皮细胞、巨噬细胞、T细胞等多种间质细胞,形成了与人肝细胞癌相同的复杂微环境。
我们发现,与非癌性肝组织相比,CTGF在该模型的癌组织中呈高表达。通过对癌组织进行单细胞RNA测序分析,发现CTGF主要在癌细胞、血管内皮细胞和肝星状细胞中表达。还发现在癌组织中,信号转导及转录激活因子3(STAT3)会与CTGF一起被磷酸化活化。STAT3一般存在于细胞质内,在细胞因子或生长因子的刺激下被Janus kinase(JAK)磷酸化,形成同源二聚体或异源二聚体,并迁移到细胞核中作为转录因子发挥作用5)。可活化STAT3的体液因子众多,在 KrasG12D小鼠的癌组织中,包括白细胞介素-6(IL-6)、白血病抑制因子(LIF)和肿瘤抑制素 M(OSM)在内的各种 IL-6 家族分子的表达均有所升高。单细胞RNA测序显示,这些IL-6家族分子主要在肝星状细胞、巨噬细胞和血管内皮细胞等间质细胞中表达。
◆肝癌细胞中CTGF的缺乏抑制肝癌细胞生长和STAT3活化
由于单细胞RNA测序表明肝细胞癌细胞表达CTGF,所以特异性地敲除了肝(癌)细胞中的CTGF(Alb-Cre KrasG12D CTGFfl/fl)(图1)。结果显示,与CTGF野生型KrasG12D小鼠癌组织相比,肝癌组织中CTGF基因的表达水平下降了30%左右。由此表明,在肝癌组织中肝癌细胞是CTGF最主要的产生来源。CTGF缺陷的KrasG12D小鼠的肿瘤数量和直径显著小于CTGF野生型 KrasG12D小鼠,表明CTGF对活体水平的肝癌细胞生长和发展具有促进作用。更趣的是,同一小鼠的癌组织中各IL-6家族分子表达减少的同时,磷酸化STAT3的表达也有所减少。
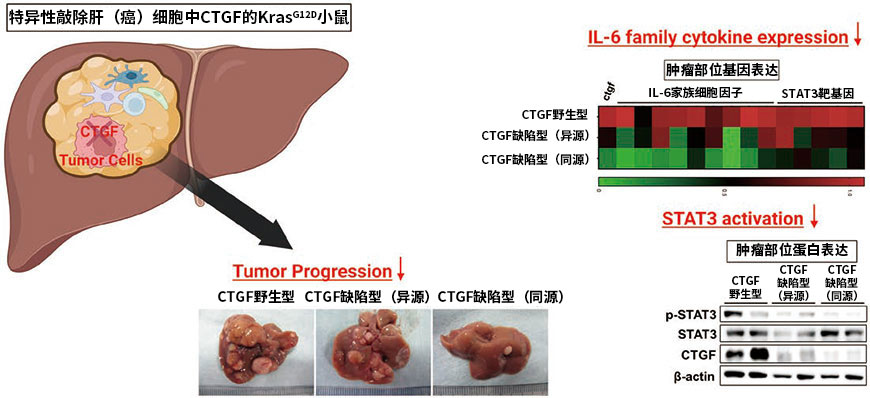
图1. 肝癌细胞中CTGF的缺乏抑制肝癌的增大和发展
(基于文献4 进行部分修改)(Created with BioRender.com)
◆肝癌细胞中STAT3的缺失抑制肝癌细胞生长和CTGF表达
STAT3在多种癌症中活化,通常被认为对肿瘤的生长和发展起促进作用5)。约60%的肝细胞癌病例中确认到了STAT3的活化,体外研究表明,STAT3可促进肝癌细胞的增殖、侵袭和迁移。而另一方面,STAT3在体内的意义的报告较少,因此STAT3在肝癌发生和增大进展中的意义尚未完全阐明。此外,STAT3在肝细胞癌中的活化机制也尚不明确,因此我们特异性敲除了KrasG12D小鼠(AlbCre KrasG12D STAT3fl/fl)肝(癌)细胞中的STAT3,并在肝癌发生模型中研究了STAT3在肝细胞癌中的意义(图2)。结果表明,即使在肿瘤形成率上没有观察到明显差异,但通过肝(癌)细胞特异性STAT3缺陷KrasG12D小鼠中的肿瘤数减少、肿瘤直径下降等表现可知,STAT3在肝癌的生长发展方面起促进作用。耐人寻味的是,与STAT3野生型KrasG12D小鼠相比,STAT3缺陷KrasG12D小鼠癌组织中的CTGF表达明显减少。
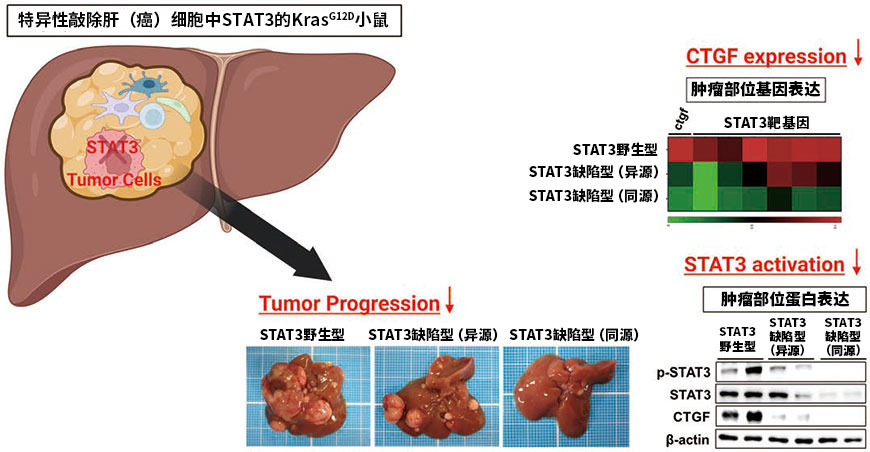
图2. 肝癌细胞STAT3的缺失抑制肝癌的生长和发展
(基于文献4 进行部分修改)(Created with BioRender.com)
◆肝癌细胞与肝癌间质细胞间的肿瘤间质反应诱导CTGF表达和STAT3活化
在STAT3缺陷KrasG12D小鼠的癌组织中CTGF表达降低的基础上,通过siRNA在体外敲除肝癌细胞系中的 STAT3后并没有发现CTGF的表达减少。因此,考虑到肝癌细胞中CTGF的表达可能受间质细胞的旁分泌刺激调控,我们将肝癌细胞系与肝星状细胞、巨噬细胞、T细胞和血管内皮细胞共培养,结果发现与单独培养相比,肝癌细胞系的CTGF和磷酸化STAT3的表达均有所增加。肝癌细胞系与各间质细胞系共培养的过程中,敲除肝癌细胞系中的STAT3会降低CTGF的表达,敲除肝癌细胞系中的CTGF会降低磷酸化STAT3的表达。在各间质细胞系中加入重组CTGF,会增加各IL-6家族分子的表达。相反,在肝癌细胞系中添加IL-6家族分子(IL-6、LIF 和 OSM)的重组蛋白会增加磷酸化STAT3和CTGF的表达。这些结果表明,肝癌细胞产生和分泌的CTGF可促进肝癌间质细胞中IL-6家族分子的表达,而肝癌间质细胞分泌的IL-6家族分子可作用于肝癌细胞,促进CTGF的表达和STAT3的活化。
◆CTGF和STAT3参与的肿瘤间质反应导致肝癌细胞的增大发展
当单独培养时,通过siRNA敲除肝癌细胞系中的CTGF或STAT3不影响细胞增殖。然而,当肝癌细胞系与各种间质细胞系共培养时,与肝星状细胞、巨噬细胞、T细胞或血管内皮细胞的共培养中均观察到肝癌细胞的细胞增殖亢进。在与间质细胞系共培养时,敲除肝癌细胞系中的 CTGF 或 STAT3 可抑制肝癌细胞的细胞增殖。在肝癌细胞系中添加重组 CTGFs 不影响细胞增殖,而加入 IL-6 家族分子(IL-6、LIF 和 OSM)的重组蛋白则会增强细胞增殖。这些结果表明,肝癌细胞中的 CTGF 和 STAT3 在间质细胞存在的情况下对肝癌细胞的增殖起促进作用,而间质细胞在CTGF 刺激下分泌的IL-6家族分子会促进肝癌细胞的增殖。
◆CTGF在人肝细胞癌切除样本中的表达及临床意义
以93例切除的人肝细胞癌样本为对象,探讨CTGF在临床样本中的表达。结果显示,CTGF在癌变肝组织中的表达高于非癌变肝组织。此外,探讨癌变部位的CTGF表达水平与临床肿瘤因子的相关性时发现,CTGF高表达病例中的肿瘤标志物(AFP、PIVKA-II)、肿瘤个数和门静脉浸润阳性率均比较高,这表明CTGF的表达水平与肿瘤分级相关。另外,对癌症组织进行的单细胞RNA测序显示,CTGF主要在癌细胞、肝星状细胞和血管内皮细胞上表达。相反,IL-6家族分子主要由各间质细胞表达,这与在KrasG12D小鼠中进行的实验结果相同。使用癌症基因组图谱(TCGA)数据库进行的分析显示,肝细胞癌组织中CTGF的表达水平与各IL-6家族分子和STAT3靶基因的表达水平呈明显的正相关关系。
以上结果表明,CTGF在肝细胞癌(主要是肝癌细胞)中呈高表达,肝癌细胞产生和分泌的CTGF作用于肝癌微环境中存在的间质细胞,并诱导间质细胞表达IL-6家族分子。揭示间质细胞产生和分泌的IL-6家族分子激活了肝癌细胞中的STAT3,诱导CTGF的表达并亢进细胞增殖(图3)。
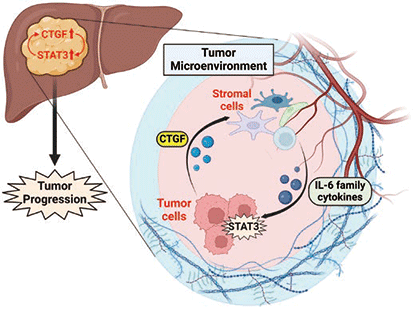
图3. CTGF和STAT3介导的肿瘤间质反应导致肝癌增大发展的机制
(Created with BioRender.com)
综上所述,CTGF作为肿瘤间质反应的介质,能够促进肝细胞癌的增大发展,有望成为肝细胞癌的治疗靶分子。CTGF作为治疗靶点的意义在几种纤维化和肿瘤疾病中是已知的,目前已开发了其抑制剂的中和抗体pamrevlumab,并进入临床试验阶段6)。重要的是,肝细胞癌通常在慢性肝病相关的肝纤维化背景下发展,CTGF已被认为与肝纤维化以及肝癌的生长和进展有关2)。由于肝纤维化的发展与肝脏储备功能降低密切相关,所以对肝细胞癌患者的肿瘤控制和纤维化管理非常重要。因此,CTGF的靶向治疗可能是同时抑制肝癌和肝纤维化的创新疗法。希望未来,靶向CTGF的新治疗方法也将被开发用于肝细胞癌,从而改善这种难以治疗的癌症的预后。
参考文献
1) Jun, J.I. et al. : Nat. Rev. Drug Discov., 10, 945 (2011).
2) Kodama, T. et al. : J. Clin. Invest., 121, 3343 (2011).
3) Makino, Y. et al. : Cancer Res., 78, 4902 (2018).
4) Makino, Y. et al. : Cell Mol. Gastroenterol. Hepatol., 15, 99 (2023).
5) Yu, H. et al. : Nat. Rev. Cancer, 14, 736 (2014).
6) Raghu, G. et al. : JAMA., 332 (5), 380 (2024).
点击此处查看相关产品页面:CTGF ELISA 试剂盒
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |