化学成分明确的补料BalanCD HEK293 Viral Feed
化学成分明确的补料BalanCD HEK293 Viral Feed
Shan Gao, Hamid Soleymani, Shahram Shahabi, Chandana Sharma, and Omid Taghavian
FUJIFILM Biosciences
HEK293 细胞是细胞和基因治疗以及疫苗开发中常用的病毒载体生产用宿主细胞系,据报道有多种策略可用于提高病毒载体的产量,包括:优化基础培养基或生长培养基、优化转染试剂或增强剂、工程改造宿主细胞等方法。虽然此类方法通常需要在完善的病毒载体生产系统中进行成本高昂的工艺优化, 但我们开发了BalanCD HEK293 Viral Feed,一种化学成分确定的补料培养基,以促进悬浮细胞培养物中病毒载体的产量。BalanCD HEK293 Viral Feed 适用广泛,适用于不同的基础培养基、转染试剂和细胞系。对于标准的批次培养,可以轻松转换为补料分批,对生产工艺流程的干扰小。BalanCD HEK293 Viral Feed在转染24小时后以12% (v/v)的量添加补料,用来提高病毒载体的产量。提高各种 HEK293 细胞系中的 AAV(腺相关病毒)滴度提高 2 倍至 8 倍,且对细胞生长和活力没有任何不利影响。在不同血清型的AAV比如AAV2,AAV5,AAV9中滴度均能提升3~6倍。这种通过补料提高产量的策略,经证实可以放大到反应器规模。
◆材料和方法
转染接种密度:PEI转染,转染前24小时细胞接种密度为1×106 cells/mL; 使用AAV-MAX 转染,转染时细胞密度为2.5×106 cells/mL。
转染试剂:Polyethylenimine (PEIpro, PolyPlus) 和来源于 AAV-MAX Helper-Free AAV Production System 的AAV-MAX 转染试剂(Thermo Fisher Scientific)
DNA:三质粒转染,包括 AAV2, AAV5, 和AAV9 质粒(GOI/Gene of interest: ZsGreen/GFP, RC: Rep-Cap, and Helper plasmids) 摩尔比为1︰1︰1;病毒载体的浓度为1 或 1.5 µg/mL 细胞悬液
DNA︰PEI 比例为 1︰2; AAV-MAX 转染试剂:每mL细胞悬液需要6 µL
使用DNA和PEI的混合液或者AAV-MAX转染试剂按照各自推荐的方法在细胞生长培养基中转染。转染24小时后添加12% v/v的BalanCD HEK293 Viral Feed。细胞裂解物用于病毒基因组和衣壳滴度测定。
◆实验结果
在三种 HEK293 细胞系中验证
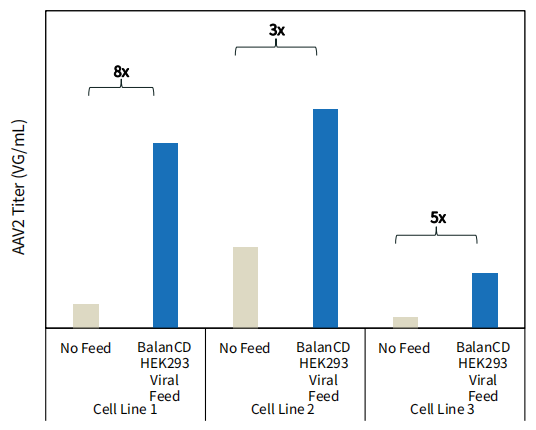
图 1. BalanCD HEK293 Viral Feed 可提高不同HEK293细胞系中 AAV2 的产量。HEK293 细胞(3 种细胞系)使用 BalanCD HEK293 培养基一式三份培养,并在转染后 24 小时补充 12% (v/v) BalanCD HEK293 Viral Feed或无补料对照(No Feed)。转染后72小时收获细胞。对于细胞系 1 和细胞系 2使用AAV 实时 PCR 滴定试剂盒 (TakaraBio) 通过 qPCR 对每个细胞培养物中的 AAV2 滴度进行定量。对于细胞系3使用数字 PCR(dPCR、QIAcuity)测定AAV2滴度。在所有情况下,均使用 ITR 引物。每个条件组上方显示了相对于无补料对照组滴度结果提升的倍数。
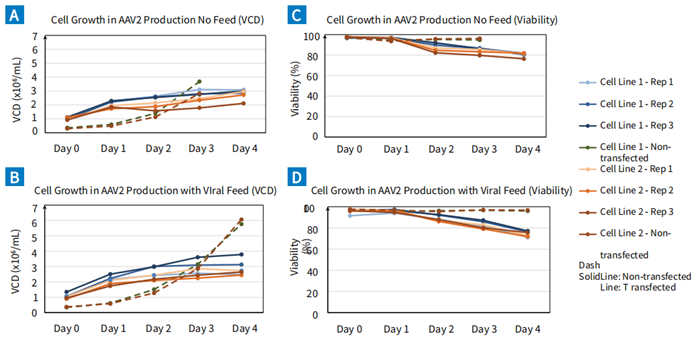
图 2. BalanCD HEK293 Viral Feed 对HEK293细胞的生长和活率没有影响。在两个细胞系(Cell Line1,Cell Line 2)中,分别测试添加BalanCD HEK293 Viral Feed与不加补料(No Feed),在培养的Day 0到Day 4的活细胞密度(A 和 B) , 细胞活力 (C 和 D) 的结果。在Day 1进行转染。虚线为对照组(不进行转染)。添加补料未对细胞的活细胞密度和活率产生影响。
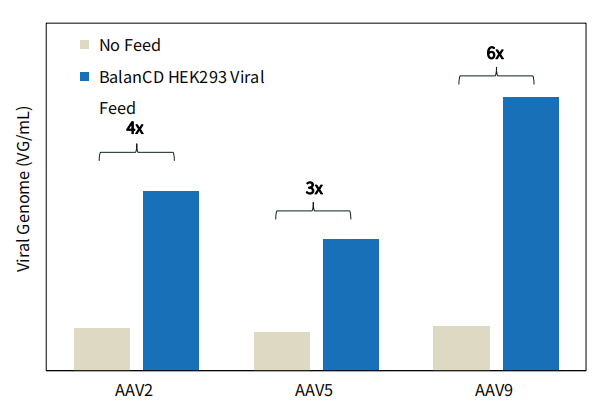
图 3. BalanCD HEK293 Viral Feed 在不同的AAV血清型中提高AAV的滴度。HEK293 细胞在 30 mL BalanCD HEK293 培养基中培养,并用表达不同 AAV 血清型的病毒载体以 1 μg/mL病毒载体浓度进行三重转染。转染后 24 小时使用 BalanCD HEK293 Viral Feed(12% v/v)进行补料。转染后72小时收获细胞。通过数字微滴PCR(ddPCR,Biorad)测量AAV滴度。每种血清型的滴度相比无补料(No Feed)时提高了数倍。
在不同的基础生长培养基中验证
BalanCD HEK293 Viral Feed 在不同的生长培养基中提高病毒载体的产量
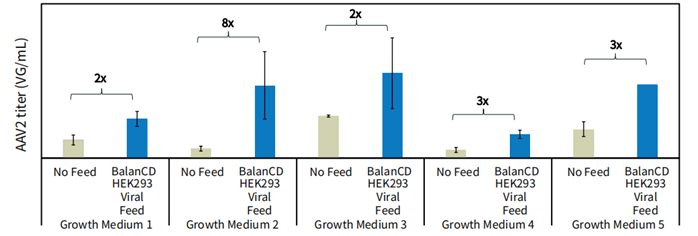
图 4. 相比于不加补料的对照组,BalanCD HEK293 Viral Feed 在不同的生长培养基中提高AAV2的产量。HEK293 细胞传代 3 次以适应不同的市售 HEK293 生长培养基(Growth Medium 1~5),并按所述转染。dPCR (QIAcuity) 使用 ITR 引物对 AAV2 滴度进行测定。误差线代表每种培养条件下一式三份细胞培养物的标准偏差,以及每个培养组的一式三份 dPCR结果。每个条件组上方显示了相对于无补料对照滴度提高的倍数。
在脂质转染中验证
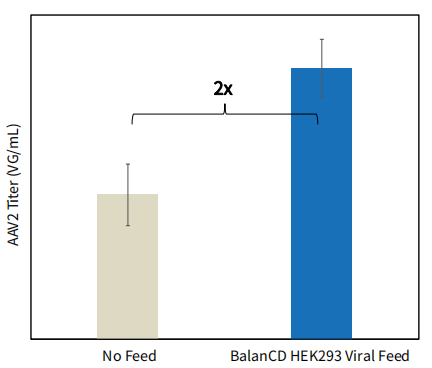
图 5. BalanCD HEK293 Viral Feed 适用于脂质转染使用AAV-MAX Helper-Free AAV 生产系统生产AAV2。细胞在BalanCD HEK293 培养基中培养,使用 AAV-MAX 转染试剂盒根据生产商的方法进行转染。转染24小时后,添加BalanCD HEK293 Viral Feed (12% v/v)进行补料。采用dPCR (QIAcuity) 使用ITR 引物测定病毒基因组滴度。误差线代表每种培养条件下细胞培养物 2 次重复的标准偏差以及每种细胞培养物 dPCR 的三次重复。每个条件组上方显示了相对于无补料对照滴度提高的倍数。
在2L和10L生物反应器中验证
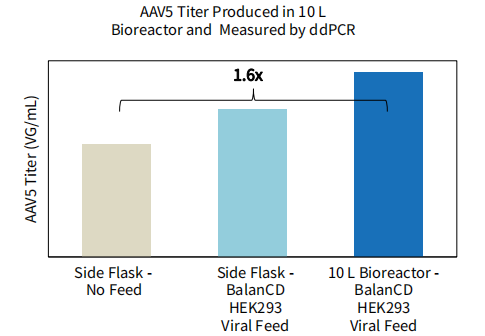
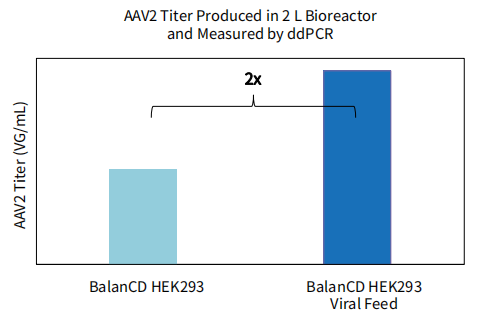
图 6. BalanCD HEK293 Viral Feed在生物反应器上的性能表现。BalanCD HEK293 Viral Feed 提高AAV2的产量在2L生物反应器上的性能验证和提高AAV5的产量在10L生物反应器上的性能验证。HEK293细胞以8×105 cells/mL的细胞密度接种于XDR2(用于AAV2产量提高性能验证)和XDR10(用于AAV5产量提高性能验证)。在转染24小时后,添加12%(v/v)的BalanCD HEK293 Viral Feed 进行补料。转染后72小时收获。AAV2和AAV5的滴度使用ddPCR测定,每个样品测量3次,测量结果的平均值绘制成上图结果。相比于对照组滴度提升的倍数也在图中显示。
在贴壁HEK293T细胞中的验证
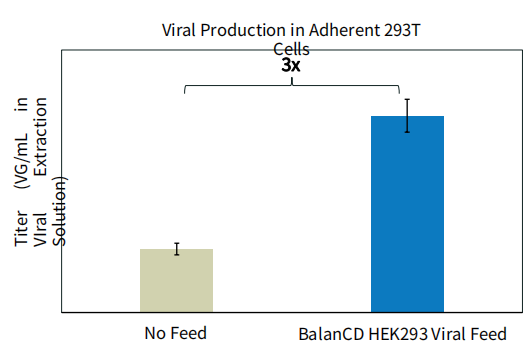
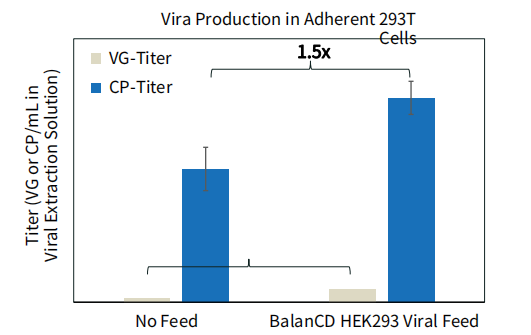
图 7. BalanCD HEK293 Viral Feed 提高AAV2在贴壁HEK293T 细胞系中的产量。HEK293T 细胞使用完全培养基(DMEM+10% FBS)接种于6孔板中,24小时后使用AAV2的三质粒(TakaraBio)转染。在转染时使用无血清的DMEM培养基代替完全培养基。细胞与DNA-PEI复合物在无血清培养基中共孵育4小时后向每个孔中加入3mL完全培养基。在转染24小时后添加BalanCD HEK293 Viral Feed (12% v/v) 进行补料。转染48小时后收获细胞。每个孔中AAV2的滴度使用dPCR测定,每个空测定3次。误差线代表每种培养条件下的细胞培养物的三次重复,以及每种细胞培养物的三次重复 dPCR结果。相比于无补料的对照组滴度提升的倍数也在图中显示。
◆总结
我们开发了一种化学成分明确、不含动物来源成分的补料培养基,通过提高2 倍至 8 倍的病毒载体产量来提高AAV滴度。BalanCD HEK293 Viral Feed支持悬浮和贴壁 HEK293 细胞系的培养,与多种基础培养基和转染试剂兼容,并且适用于多种 AAV 血清型。通过这项研究,我们展示了一种简化的、可扩展的工艺,可以将用于细胞和基因治疗的病毒载体从分批生产转变为补料分批生产。
点击此处查看相关页面:BalanCD HEK293 Viral Feed
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |