
DNA是组成生物设计图基因的化合物,DNA相关的研究为生命科学领域的发展作出了巨大贡献,如今已成为诊断、治疗、食物和能量等人类丰富生活基础的重要支柱。FUJIFILM Wako可提供广泛的DNA研究相关试剂。
◆什么是DNA
脱氧核糖核酸(Deoxyribonucleic acid,DNA)是记录和传递生物体内遗传信息的化学物质,由五碳糖 2'-脱氧核糖、磷酸和碱基组成。DNA的碱基有4种,分别是具有嘌呤骨架的腺嘌呤(Adenine / A)和鸟嘌呤(Guanine / G),以及具有嘧啶骨架的胞嘧啶(Cytosine / C)和胸腺嘧啶(Thymine / T)。腺嘌呤与胸腺嘧啶、鸟嘌呤与胞嘧啶可以通过氢键形成互补的碱基对。
DNA中核酸的最小单位是脱氧核糖核苷酸,它由连接在2'-脱氧核糖1'位置的碱基和连接在5'位置的磷酸基团组成。脱氧核糖核苷酸通过磷酸酯键以线性方式连接,磷酸酯键连接脱氧核糖的 5' 位磷酸基团和 3' 位羟基,形成长而细的多核苷酸链。两条多核苷酸链互相作为模板,反方向排列,组成了双螺旋结构的双链DNA。
碱基的排列方式称为碱基序列,即遗传信息的主体。三个碱基排列在一起称为密码子,每个密码子对应编码一个氨基酸。DNA是从5’端向3’端读取,最终合成编码的氨基酸。

◆什么是RNA
核糖核酸(Ribonucleic acid / RNA)是由核糖(一种五碳糖)、磷酸和碱基组成的核糖核苷酸链接而成的核酸。RNA中的碱基有四种,分别是嘌呤骨架的腺嘌呤(Adenine / A)和鸟嘌呤(Guanine / G),嘧啶骨架的胞嘧啶(Cytosine / C)和尿嘧啶(Uracil / U)。
这种结构使RNA在生物体内发挥着重要的作用,如参与蛋白质的合成过程。腺嘌呤和尿嘧啶,以及鸟嘌呤和胞嘧啶可以通过氢键形成互补的碱基对。
RNA主要参与基因信息的传递和表达,包含转录DNA遗传信息的信使RNA,链接信使RNA和氨基酸的转运RNA,组成翻译所需核糖体的核糖体RNA等。
RNA通常以单链状态存在,不受DNA双螺旋结构限制。因此根据碱基序列的不同,可以在局部形成茎–环等双链结构,有些甚至可以形成更复杂的三维结构。具有高维结构的RNA部分还有催化活性,在细胞内作为酶发挥作用的RNA称为核酶。代表性的核酶有从前体RNA中切割tRNA的RNase P。
◆DNA和RNA的不同
脱氧核糖核酸(DNA)和核糖核酸(RNA)非常相似,区别在于以下两点:
① DNA主链使用的糖是2'-脱氧核糖,RNA主链使用的糖是2' 位含有一个羟基的核糖。
2' 位羟基的存在会影响核酸的稳定性,一般来说,RNA比DNA不稳定,主要是因为它含有2' 位羟基。2'位羟基上的质子容易被碱性物质带走,失去质子后的氧原子会攻击形成磷酸二酯键的磷原子,从而切断核糖核苷酸之间的连接(见图1)。相同的机制还有分解RNA的RNA分解酶(RNase),弱碱性条件下以及RNase的存在会导致RNA非常容易分解。将2'位的羟基改为O-甲基基团(-OMe)的修饰核苷酸,其五元环结构与核糖核苷酸相同,呈C3'-endo型(5'位和3'位的碳原子朝向相同),并因其不易水解,所以可广泛用于在核酸药物等领域。
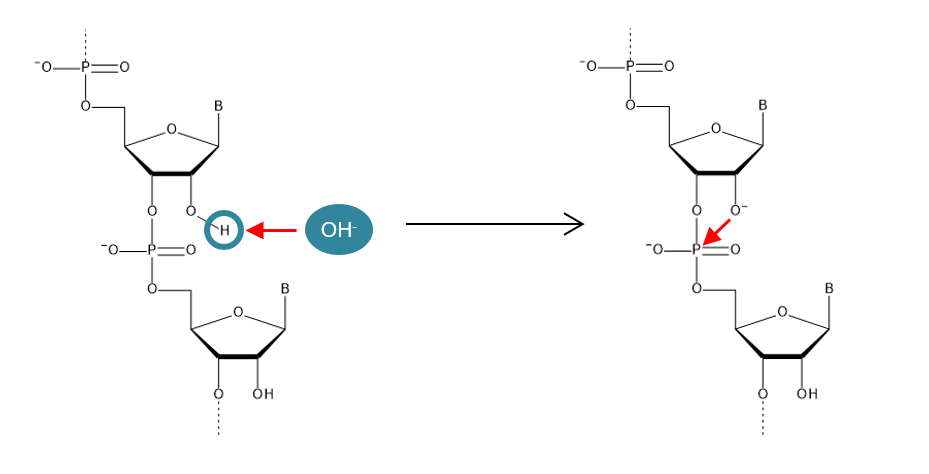
图1. RNA水解机制
② DNA使用胸腺嘧啶(thymine)作为碱基,而RNA则用尿嘧啶(uracil)代替胸腺嘧啶。
DNA使用胸腺嘧啶,RNA使用尿嘧啶,这两种碱基的结构非常相似,唯一的区别是5'位上甲基的有无,胸腺嘧啶也可以称为5'-甲基尿嘧啶。因此,双方皆可与腺嘌呤形成互补配对。
DNA不使用尿嘧啶的原因可能是因为尿嘧啶是胞嘧啶自然脱氨反应的生成的碱基。如果DNA使用尿嘧啶作为碱基,就无法识别由胞嘧啶脱氨反应产生的尿嘧啶和天然存在的尿嘧啶。因此DNA不含尿嘧啶,DNA修复机制就可以将由胞嘧啶脱氨反应产生的尿嘧啶识别为异常,并将其修复为胞嘧啶。
◆RNA的种类和功能
细胞内的RNA种类多样,并担任着不同的职责,下文将介绍RNA的种类及其功能。
mRNA是由RNA聚合酶从基因(DNA)转录而来、编码蛋白质序列信息的RNA。在真核生物中,mRNA在细胞核内从DNA转录后,会经历RNA加工过程,包括RNA加帽、多聚腺苷酸化和剪接等。经过加工的成熟mRNA被输送到细胞核外,并被翻译成蛋白质。据说常规的哺乳细胞中总RNA的1~5%为mRNA。
与DNA不同,RNA无需转移至细胞核,且整合到基因组的可能性较低。此外,RNA相比蛋白质更易于生产和修饰,因此在核酸药物和疫苗领域备受关注。尽管此前生物体给药的稳定性低且会出现免疫原性问题,但随着修饰碱基、Cap1的应用以及药物递送系统的发展,也逐步实现了RNA的实际应用。
转运RNA(transfer RNA / tRNA)
tRNA是兼具解码密码子功能与连接密码子指定的氨基酸的适配器RNA,tRNA为三叶草结构,包含与mRNA密码子互补配对的反密码子区域,和与适配密码子结合的氨基酸区域。tRNA占哺乳细胞中总RNA的15%~20%。
核糖体RNA(ribosomal RNA / rRNA)
rRNA是与核糖体蛋白共同构成翻译装置核糖体的RNA,一般占哺乳细胞中总RNA的80%~85%。通过离心力作用下的沉降速度检测,明确真核生物中存在5S、5.8S、18S和28S的rRNA,而原核生物中存在5S、16S和23S的rRNA。部分rRNA可以形成三级结构,并作为核酶(ribozyme)发挥作用,在蛋白质翻译过程中催化氨基酸之间形成肽键。
microRNA是由22个碱基组成的功能性小分子RNA(small RNA)的一种,作为引导分子在转录后水平上调控基因表达,并在多种生物学功能中发挥作用。研究人员认为,人和小鼠中编码了1,000多种的microRNA,关于新型microRNA的功能阐明和与疾病相关microRNA的探索研究也正在全球范围内盛行。此外,还有报道称microRNA不仅存在于细胞内,还存在于血液等体液中,所以它作为癌症等疾病的临床诊断标志物也备受关注。
然而,除miRNA以外,功能性小分子还有内源性siRNA (endogenous small interfering RNA)和piRNA (PIWI-interacting RNA)等,它们的碱基数量略有不同。由于结合的AGO蛋白不同,可以利用这些结合蛋白通过免疫沉淀等方法进行分离。
其他RNA
此外,还有一些存在于细胞核内,参与RNA剪接等过程的核内小分子RNA(small nuclear RNA / snRNA)以及存在于核仁中,参与rRNA修饰等的小核仁RNA(small nucleolar RNA / snoRNA),它们作为功能性小分子RNA早已被熟知。
◆基因工程实验史
1953年,由J. Watson和F. Crick提出了DNA的双螺旋结构。两条螺旋分别以反方向连接,且碱基朝向内侧,与脱氧核糖相连的磷酸朝向外侧。如果一条螺旋的碱基是A,那么与之配对的碱基必定是T;如果一条是G,那么与之配对的必定是C。相对的碱基通过氢键连接,从而稳定螺旋结构。这不仅暗示了遗传信息复制的机制,还表明DNA包含遗传信息。1958年,F. Crick提出了中心法则2),阐明了遗传信息由DNA转录至mRNA,翻译并表达为蛋白质的过程。
然后,1966年,B. Weiss和C. Richardson分离出了可以连接 DNA的 DNA 连接酶;1968年,瑞士的W. Arber 和美国的 H. Smith 发现了能够识别和切割基因内特定碱基序列(回文结构)的限制性内切酶。此外,1972年,斯坦福大学的P. Berg成功地将致癌病毒SV40的DNA导入大肠杆菌,进行了基因重组实验。次年,S. Cohen和H. Boyer开发了使用质粒的大肠杆菌基因重组技术。
以P. Berg为首的主要研究者们,对这种基因重组技术的进步产生了危机感,并于1975年在加利福尼亚州召开了阿西洛马会议,讨论了基因重组的潜在危险性,并制定了基本准则。
1980年代前半期,基因工程发展成熟,许多基因被成功克隆。1982年,全球首个基因重组药物人胰岛素获得批准。
1983年,作为新型基因扩增方法的聚合酶链式反应(Polymerase Chain Reaction / PCR)法被发明,可更轻松地实现目标基因的复制。此外,1976年发现的Taq DNA聚合酶3)实现了PCR法的自动化,并迅速成为常见的实验室技术。这也促进了PCR法在DNA鉴定以及基因诊断和治疗中的应用4)5)。1993年,发明了PCR法的K. Mullis获得了诺贝尔化学奖。
1983年,PCR法提出的同年,A. Feinberg和B. Vogelstein报道了大肠癌组织中存在DNA的低甲基化6),这表明表观遗传学与人类癌症的发展相关。1987 年,R. Holliday报道了DNA甲基化与表观遗传学在致癌和衰老中的相关性7)。这些不改变 DNA 的碱基序列来控制和传递基因表达的研究成为了表观遗传学研究的先驱。
1990年代,伴随利用测序技术的大规模基因组分析技术的建立,大量生物的基因组项目取得了进展。人类基因组计划始于1990年,于2003年完成。2005年,可以同时处理数百万个测序反应的新一代测序仪(Next generation sequencer / NGS)投入实际应用。NGS能够在短时间内确定大规模基因组序列,并在个性化医疗、遗传疾病的诊断和治疗以及制药等领域发挥重要作用。此外,NGS也促进了宏基因组分析技术的发展,进而推动了微生物组分析的进步。
目前,后基因组学研究涉及更大规模、更复杂的分析,例如蛋白质组学、转录组学和生物信息学。此外,随着 ZFN、TALEN 和 CRISPR-Cas9 等基因组编辑技术的出现,使得在单碱基水平上修改基因变得更加容易。
◆参考文献
1) Watson, J. D. and Crick, F. H.:Nature, 171, 964(1953).
2) Crick, F. H.: Symp Soc Exp Biol, 12(138-63), 8(1958).
3) Chien, A., Edgar, D. B. and Trela, J. M. :Journal of bacteriology, 127(3), 1550(1976).
4) Saiki, R. K. et al.:Science, 230(4732), 1350(1985).
5) Mullis, K. B. and Faloona, F. A. :Methods in enzymology, 155, 335(1987).
6) Feinberg, A. P. and Vogelstein, B.:Nature, 301(5895), 89 (1983).
7) Holliday, R.:Science, 238(4824), 163(1987).
8) 平尾一郎, 胡桃坂仁志 編:「目的別で選べる核酸実験の原理とプロトコール」 (羊土社) (2011).
9) 塩見美喜子, 中川真一, 浅原弘嗣 編:「ノンコーディングRNAテキストブック」 (羊土社) (2015).
10) Watson, J. D.他著, 中村桂子 監訳:「ワトソン 遺伝子の分子生物学(第7版)」 (東京電機大学出版局) (2017).
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |