我们将为大家介绍市售的ELISA试剂盒的一般操作方法和要点。我们推荐的方法可能会和试剂盒制造商推荐的方法不同。实际使用时请按照试剂盒的说明书进行操作。
◆要点①:测定前的检查
【收货时的检查要点】
确认收货时产品的状态。对收货时产品的运输温度,包装完好性等状况进行确认。
【冷藏品保存要点】
● 如果试剂不能冻结,放入冰箱前检查设定的温度是否合适。
● 为避免试剂冻结,不要把试剂放在冰箱出风口直接对着冷气的位置。
● 冰箱的温度过低可能会导致试剂盒里浓缩清洗液中的盐离子析出。
● 正确摆放试剂,避免试剂倒置或侧向放置。
● *孔板中填充了稳定保存液,倒置存放的话会使抗体固相面接触到气泡。
【实验室及仪器的检查要点】
● 选择能保证反应温度的实验室。
● 不要靠近空调,恒温器,高压灭菌器,电脑等热源。
● 选择气流较小的地方(推荐风速低于0.4m/sec)。
● 推荐湿度30%以上。
● 避免阳光直射。
● 要定期校正移液枪。
● 定期保养自动洗板机和酶标仪等仪器。
◆要点②:正确使用移液枪
● 关于移液枪的操作
在ELISA检测中,标准溶液的配制,试剂溶液的稀释配制以及将标准溶液、检测样本或试剂溶液分注到96孔板中都需要用到移液枪。为了使这些操作都有良好的重复性,最好使用操作熟练的移液器,并按照移液枪的操作规程进行操作。
● 关于移液枪的选择
向96孔板中分注5μL,10μL,50μL,100μL等体积的溶液时。选择量程合适的移液枪,例如,分注5μL时选择最大量程为10μL的移液枪,分注50μL时选择最大量程为100μL的移液枪。
96孔板全部分注时最好使用连续分液器。使用校准保养过的电动移液器。
要点③:如何向孔板中加液
【加液前的准备】
● 对96孔板做好标记,确认好加入孔板中的溶液种类。
● 96孔板恢复至室温后撕去上面的封板膜。
● 带金属盖的孔板在拿掉盖子时要用油性笔在盖子的边缘标记编号。
● 如果试剂盒里全部试剂都需要恢复至室温,请在恢复至室温后再使用(复温要1个半至2个小时),特别是缓冲液和清洗液。
【标准液的分注】
● 从0浓度(Blank)或者浓度最低的标准液开始分注。连续分注时最好也从浓度低的孔开始。
● 20分钟左右完成一块孔板的溶液分注。进行高精度的分液操作时,特别要注意孔板的干燥。
● 如果不是连续分液,那么每分注一个孔最好更换一个枪头,避免交叉污染。
● 检测样本需要稀释时,要事先稀释好。
● 注意不要忘记加入标准液,检测样本和二抗。
● 加液时避免产生泡沫。

实用小提示:往96孔板中分液时,如果担心孔板移动,可以在96孔板下面放一块防滑垫后再进行分液操作。
◆要点④:枪头使用方法
枪头的使用方法主要有两种。最好统一使用一种方法。
● 预先浸湿法
1. 装好新的枪头后,在第一停点(移液枪最初停止的位置)的范围内吸取、排出溶液1~2次,即进行“预先浸湿”,再吸满溶液。
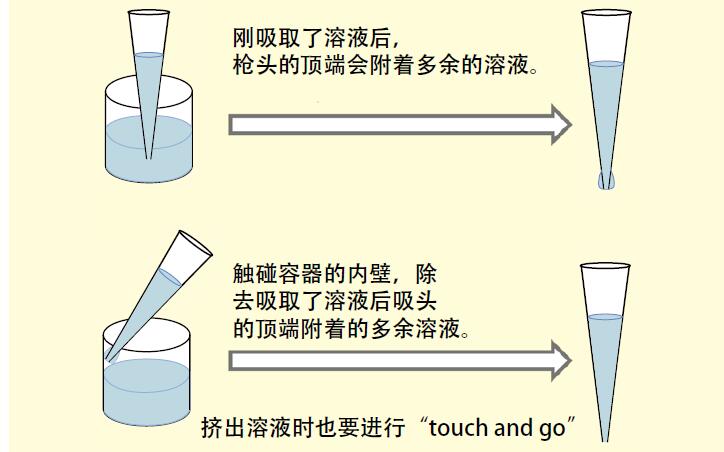
2. 用枪头的顶端轻轻触碰容器的内壁,去除顶端外侧附着的溶液后提起移液枪(touch and go)(图1)。
3. 让枪头的顶端接近板孔内壁,排出溶液。 这时,将按钮按到底,排出全部溶液(blow out)。
4. 在孔的内壁进行touch and go后提起移液管,更换枪头。这时注意枪头的顶端不能接触到内壁。
● 共洗法
这种方法适用于已经将缓冲液等加入孔板或试管里的情况。最好在分注微量检测样本或微量标准液时使用这种方法。
1. 装好新的枪头后,按压按钮到第一停点的位置,轻轻地吸取溶液。
2. 在容器的内壁进行“touch and go”后提起移液枪。
3. 将枪头的顶端放进已经加入缓冲液的孔中排出溶液,在第一停点的范围内上下按压按钮 “共洗”1-2次,最后排出全部溶液。
4. 在孔的内壁进行touch and go后提起移液枪,更换枪头。分注时枪头的顶端不要接触96孔板的内壁。
移液时的要点(一例)
要灵活运用预先浸湿法和共洗法来进行正确的注液。避免移液枪排出溶液时产生气泡。移液时枪头不要接触孔的底面和内壁,避免剥离固定的抗体。要用稳定的速度来按压移液枪。最后再进行“touch and go”。
◆Q&A
Q:为什么不能一个检测样本一个孔地进行检测呢?
A:
● 从检测的操作方法上来看
只检测1个孔,就会缺少支持这个检测结果的相关数据。如果检测操作出现失误或移液有误差,就不能进行比较讨论了。如果检测结果和同一实验组的其他试剂的检测结果差距不大的话,大致能推断检测操作没有问题,保险起见,可进行两重、三重的实验检测,这样统计的测定值,就能断定检测操作无误。
那么,如果二重检测中两个检测值差距很大的话该怎么办呢?不要去判断两个检测值的正确与否,而是要从属于同一实验组的其他试剂的比较来考虑。如果是做三重检测的话就可以排除一个和另外两个检测值差距很大的检测值。严格来说,能对检测值的准确性进行判断是最理想的,但样本数量很少的话就很难进行判定,尤其是做二重检测就很难判断。如果两次的检测值相距不大的话就取它们的平均值。
● 从统计学的角度来看
一个孔的自由度为零,所以在统计学上的信任度也为零。进行二重、三重检测我们可以计算出平均值和标准误差,所以能判断检测值的可信度在95%以上。表示平均值分布形式的标准误差与取样数的平方根成反比。因此取样越多平均值的可信界限就会越小,数值可信度就越高。另一方面,虽然表示标本分布形式的标准偏差几乎与取样数量无关,但其可信度还是依赖于样本数量。
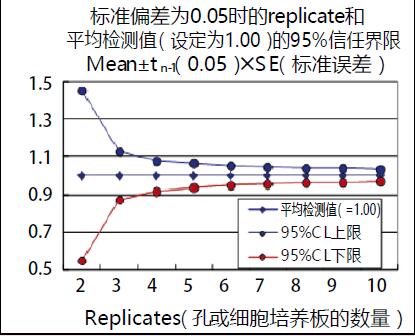
下面的图表展示了将平均检测值设定为1,标准偏差设定为0.05(也就是说相对标准偏差或变异系数为5%)时,反复进行检测,即孔的数量和求得的平均值的95%信任区间。单次检测另当别论,二重检测的平均值的信任区间大约在50%左右,三重检测的信任区间要强约10%左右。所以我们至少要进行二重检测。
下回是“第3回 ELISA的操作方法及其要点(中篇)”。
本报道根据若林克己著的《ELISA A to Z》(Shibayagi株式会社发行),由Shibayagi株式会社进行编辑。
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |