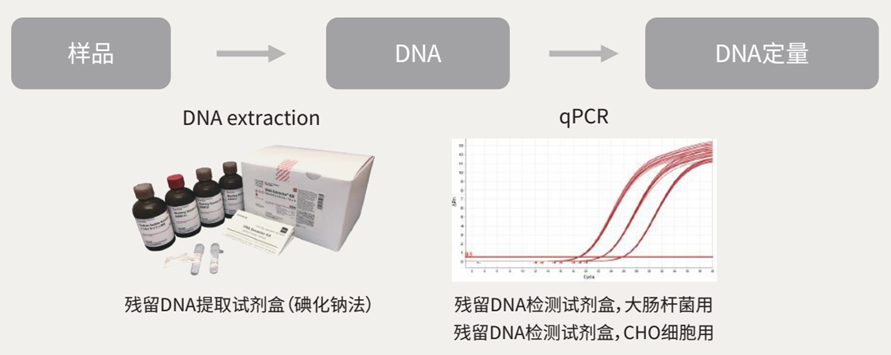
在生物制药的生产过程中,宿主细胞携带的残留DNA可能会带来致癌性、传染性和免疫调控风险。
因此需要对生产过程来源的杂质进行管理。世界卫生组织(WHO)、美国食品药品监督管理局(FDA)和欧洲药典(EP)为最终的宿主来源残留DNA含量限制提供了指南标准,即应当少于10 ng/剂或100 pg/剂。
除了一直以来提供的符合中国药典标准的残留DNA提取试剂盒(碘化钠法),最近FUJIFILM Wako还全新推出了用于大肠杆菌 和CHO细胞的残留DNA检测和定量试剂盒。
◆QCdetect ™ Residual DNA Detection Kit for E. coli
本产品是使用qPCR法(探针法)定量大肠杆菌来源基因组DNA的试剂盒。
推荐用于生物制药的质量管理以及生产工艺开发中的宿主细胞来源残留DNA检测。
● 检测下限:≥0.003 pg/test
● 定量下限:≥0.03 pg/test
● 高线性的标准曲线
● 批次间差异小,再现性高
● 使用预混合缓冲液,操作简单
● 不易受样品所含杂质的影响
● 含Internal Control(内标)
产品编号 | 产品名称 | 产品规格 |
QCdetect™ Residual DNA Detection Kit for E. coli | 100 tests |
点击此处了解产品详情
◆QCdetect ™ Residual DNA Detection Kit for CHO cells
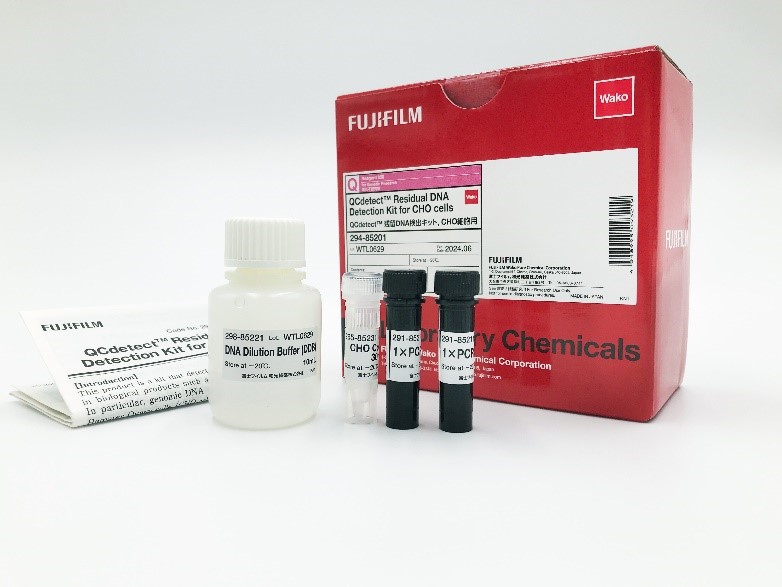
本产品是使用qPCR法(探针法)定量CHO细胞来源基因组DNA的试剂盒。
推荐用于抗体药物及其生产工艺中的残留DNA检测。
● 检测下限:≥0.0003 pg/test
● 定量下限:≥0.003 pg/test
● 高线性的标准曲线
● 批次间差异小,再现性高
● 使用预混合缓冲液,操作简单
● 不易受样品所含杂质的影响
● 含Internal Control(内标)
产品编号 | 产品名称 | 产品规格 |
QCdetect™ Residual DNA Detection Kit for CHO cells | 100 tests |
点击此处了解产品详情
◆残留DNA提取试剂盒(碘化钠法)
残留DNA提取试剂盒遵照中国药典记载的碘化钠法,适用于疫苗和治疗用生物制品所含宿主细胞残留DNA的提取。
残留DNA提取试剂盒可以提取样品中含有的极微量的DNA,回收率较高。DNA的提取操作时间为60-90 min。提取的DNA可以通过qPCR进行定量。适用于CHO细胞、大肠杆菌、酵母等宿主细胞来源DNA量的检测及管理。
● 高回收率,回收痕量DNA(100-1,000 fg)
● 全程单管操作,无需换管
● 提取全程仅需60-90 min
● 提供含高浓度蛋白样品用的流程
● 遵照中国药典收录碘化钠法*1
*1 为使DNA检测方法与国际标准保持同步,中国药典(The Chinese Pharmacopoeia)宣布建立残留细胞DNA检测国家标准。碘化钠法作为 残留DNA提取方法,新增至2020版的中国药典。
产品编号 | 产品名称 | 产品规格 |
DNA Extractor® Kit for Residual DNA, CP Method (Sodium Iodide Method) 残留DNA提取试剂盒(碘化钠法) | 50 tests |
点击此处查看产品详情
点击此处下载宿主细胞残留检测系列宣传页 |
※ 本页面产品仅供研究用,研究以外不可使用。
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |