
应用示例
◆概要
本应用示例提供了在24孔G-Rex细胞培养系统中使用Shenandoah CTGrade GMP rh IL-2C126S、IL-7、IL-15和 IL-21(产品编号分别为:500-01、500-07、500-08、500-09)激活扩增PRIME-XV T细胞CDM中三个不同供体的外周血单核细胞(PBMC)的数据。
◆引言
γc细胞因子家族因相关白细胞介素之间互补、重叠和独特的免疫调节功能而闻名。作为 γc 家族的成员,白细胞介素2(IL-2)是人体免疫反应的重要调节因子。IL-2主要由T细胞生成和消耗,可刺激适应性免疫细胞和先天性免疫细胞的扩增和激活。尽管IL-2是T细胞扩增中应用最广泛的γc细胞因子,但也有充分的研究数据表明,该家族的其他成员也会以细微的方式对T细胞的扩增和发育产生影响。白细胞介素(如 IL-7、IL-15 和 IL-21)可影响记忆细胞群的分布、耐受性、极化以及适应性和先天性免疫反应的各个方面,它们被迅速与开发不依赖IL-2的细胞疗法产品方面的应用关联起来。γc家族中的白细胞介素是生产许多免疫疗法和细胞疗法的关键成分,其生产需要高质量的重组蛋白。更具体地说,使用可靠的重组蛋白进行治疗药物的生产可较大限度地减少批间差异,有助于产品从开发的早期阶段顺利过渡到临床和商业应用阶段。
FUJIFILM Biosciences的CTGrade GMP重组人蛋白在大肠杆菌系统中生成,可呈现出批次间一致的生物活性和批次间高重复性。这些CTGrade GMP细胞因子在采用cGMP且通过ISO 9001:2015认证的工厂中生产,兼容研究用 (RUO) 重组蛋白,以确保从临床前开发过渡到疗法和其他产品的cGMP级生产时的变化因素降至最低。
◆所需材料
试剂 | 耗材 | 设备 |
• PRIME-XV T Cell CDM (FUJIFILM Biosciences,Catalog #91154) • Phosphate Buffered Saline (PBS) (FUJIFILM Biosciences,Catalog #9240) • Dynabeads (ThermoFisher, Catalog #11132D) • CTGrade rh IL-2C126S (FUJIFILM Biosciences,Catalog #500-01) • CTGrade rh IL-7 (FUJIFILM Biosciences,Catalog #500-07) • CTGrade rh IL-15 (FUJIFILM Biosciences,Catalog #500-08) • CTGrade rh IL-21 (FUJIFILM Biosciences,Catalog #500-09) • Fresh human PBMCs (StemExpress, Catalog #PBMNC300F) | • Gas Permeable Rapid Expansion (G-Rex) cell culture system (WilsonWolf Manufacturing # 80192M) • 15 mL sterile conical tubes • P1000, P200, P20, and P2 micropipette sterile tips • 5, 10, and 25 mL serological pipettes | • P1000, P200, P20 and P2 micropipettes • Serological pipette controller • Centrifuge • Humidified tissue culture incubator • ViCell XR cell analyzer • FACSymphony A3 |
方法1:CTGrade rh IL-2C126S 搭配 PRIME-XV T Cell CDM |
实验设计
• 在24孔G-Rex细胞培养容器中扩增 • 使用从3个不同供体中新鲜分离的PBMC进行试验 • 每种条件分成两组进行培养(设置复孔) • 在4个时间点(day3、day7、day10和day13)分别进行单独培养 • 第5天和第10天时将相应孔板更换为75%的培养基 |  |
培养基准备
1. 根据培养基条件确定所需体积
a. 共12个单独的培养条件(4批次CTGrade rh IL-2C126S,3种浓度)
i. CTGrade rh IL-2C126S: 100 IU/mL, 200 IU/mL, and 1,000 IU/mL
b. 各条件下,每个孔板有2个7 mL的培养孔
c. 每个时间点各3个孔板(3个供体中的每个供体都需设置)
d. 第3天时,孔板无需更换培养基
e. 第7天和第10天时,孔板各更换1次培养基(每孔5.25 mL)
f. 第13天时,孔板需更换2次培养基(每孔11 mL)
g. 各条件所需的培养基总体积:
[1孔板×(2孔×7 mL/孔)+ 2孔板×(2孔×(7 mL/孔+5.25 mL/孔))+1孔板×(2孔×(7 mL/孔+ 11.5 mL/孔)孔))] ×3供体=各条件330 mL
2. 制备350 mL PRIME-XV T Cell CDM,每个批次使用3种浓度的CTGrade GMP rh IL-2C126S
误差范围的额外体积
接种细胞
3. 计算每个供体所需的细胞数量
a. 接种密度 = 5×105 cells/cm2
b. 每孔板24个孔
c. 每个供体4个时间点(孔板)
5×105 cells/cm2×2 cm2/well×24 wells/plate×4 plates/donor = 9.6×107cells/donor
4. 根据实验方案使用Dynabeads激活每个供体的9.6×107个细胞
9.6×107 cells×1 Dynabead/cell×1 mL/4×107Dynabeads = 2.4 mL Dynabeads per donor
5. 使用Dynabeads激活后,将每个供体重悬于9.6 mL PRIME-XV T Cell CDM(不含CTGrade GMP rh IL-2C126S)中,
并用移液管充分轻吹混匀,以形成均匀的细胞悬液。
6. 从每个供体中取100 μL细胞悬液,分别添加至四个24孔G-Rex板的每个孔中。
7. 从步骤2的培养基中取7 mL添加至每个孔板相应的孔中,并在标准的组织培养条件下进行培养。
细胞收集和分析
8. 在适当的时间点进行补料添加和收集
a. 收集day3孔板中的细胞并计数,使用PBMC流式细胞仪面板进行染色
b. 在第5天时对day7、day10和day13的孔板进行补料,从每个孔中吸出5.25 mL培养基,更换为5.25 mL添加了CTGrade rh IL-2C126S的培养基。
c. 收集day7孔板中的细胞并计数,使用PBMC流式细胞仪面板进行染色
d. 在第5天时对day13的孔板进行补料添加,从每个孔中吸出5.25 mL培养基,更换为5.25 mL含有CTGrade GMP级别的rh IL-2C126S的培养基。
9. 在实验的最后一天收集day13孔板中的细胞,并将细胞群分成3组:用于计数的细胞、用于表面染色的细胞以及用于功能测试和细胞内染色的细胞。
a. 与前述的时间点采取同样的方法,对细胞进行计数和表面标记染色
10. 准备进行细胞功能测试
a. 将约2×106 cells/well分别加入96孔圆底有盖板中(其中一个将作为未刺激的对照组)
b. 对两个孔板进行CD107a染色
c. 用葡萄球菌肠毒素 B (SEB) 刺激其中一个孔板
d. 在标准组织培养条件下,将两个孔板孵育2 h
e. 在两个孔板中加入蛋白转运抑制剂,并孵育4 h
11. 开始进行细胞内染色
a. 固定和渗透细胞
b. 对细胞进行细胞内标记和细胞因子染色
c. 启动流式细胞仪
结果
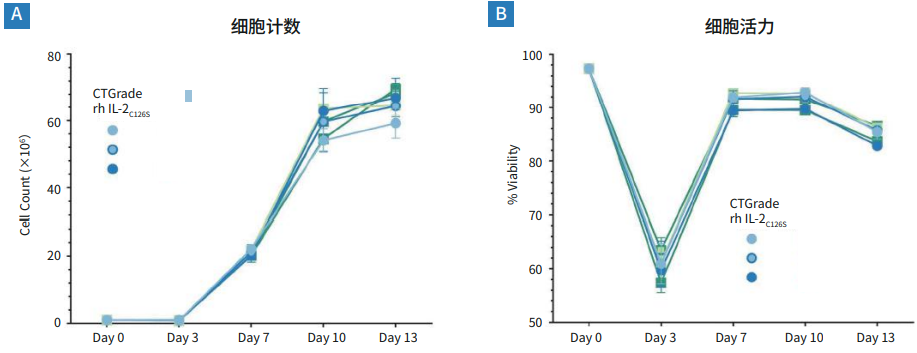
图1. 添加了不同浓度CTGrade GMP rh IL-2C126S的PRIME-XV T Cell CDM中,新鲜的人PBMC显示出强劲的扩增能力和高存活率。
(A)day13时,使用两种较高浓度的CTGrade GMP rh IL-2C126S进行培养的细胞在细胞生长方面没有明显差异,而使用最低浓度的CTGrade GMP rh IL-2C126S进行培养的细胞却没有得到很好的扩增。这意味着 CTGrade GMP rh IL-2C126S 约在200 IU/mL达到发挥作用的饱和上限。
(B) 在day3时细胞活力下降的原因通常是活化诱导的细胞凋亡,这一情况在day7完全恢复。整个培养过程中的细胞存活率均保持在85%以上,所有浓度和来源的 CTGrade GMP rh IL-2C126S都同样对细胞存活有着正面影响。以上结果呈现了使用3个供体和3种浓度的CTGrade GMP rh IL-2C126S分别进行重复试验的结果。
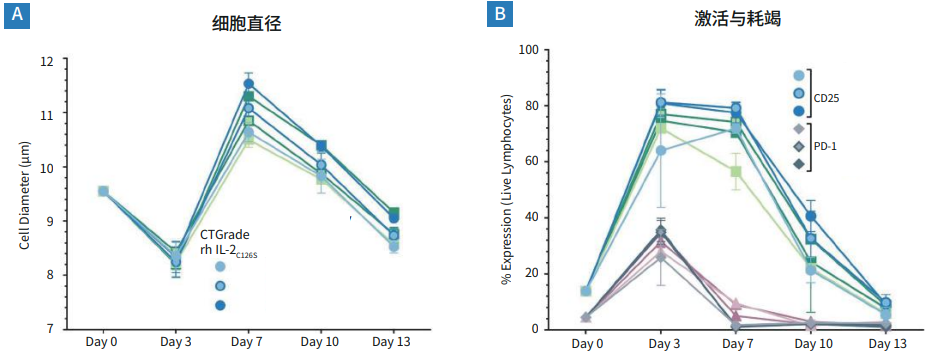
图2. 在添加了不同浓度CTGrade GMP rh IL-2C126S 的PRIME-XV T Cell CDM中,新鲜的人PBMC显示出健康的活化动力学。
(A) 激活后细胞直径的增加呈现出轻度的剂量依赖性。(B) 细胞活力在day3下降的同时,PD-1也在增加,直到扩增后的day7,PD-1已降至可以忽略不计的水平。活化标记物CD25在扩增后第一周保持高水平,在最低浓度的CTGrade GMP rh IL-2C126S存在下轻微下降,在day13恢复到基线。以上结果呈现了使用3个供体和3种浓度的CTGrade GMP rh IL-2C126S分别进行重复试验的结果。
| |
| 图3. T细胞亚群的分布在整个扩增过程中保持一致,细胞在扩增后保留完整的功能。 (A)CD4+︰CD8+的比率在最初下降后,从激活到扩增一直保持不变。 (B)CD4+细胞在超抗原刺激后产生强烈的Th1反应和轻微的Th2反应。 (C)CD8+细胞在超抗原刺激后分泌炎性细胞因子和细胞溶解分子。CD4+和CD8+反应的强度与CTGrade GMP rh IL-2C126S的浓度无关。以上结果呈现了使用3个供体和3种浓度的CTGrade GMP rh IL-2C126S分别进行重复试验的结果。 |
方法2:CTGrade rh IL-7, 15, 21 搭配 PRIME-XV T Cell CDM |
实验设计
• 在24孔G-Rex细胞培养容器中扩增 • 使用从3个不同供体中新鲜分离的PBMC进行试验 • 每种条件分成三组进行培养 • 在3个时间点(day3、day7、day10)分别进行单独培养 • 第5天时将相应孔板更换为75%的培养基 |
|
培养基准备
1. 根据培养基条件确定所需体积
a. 总24个独立条件(每种细胞因子提供4批次、2种浓度对3个供体进行试验)
i. CTGrade rh IL-7:5 ng/mL 和 10 ng/mL
ii. CTGrade rh IL-15:5 ng/mL 和 10 ng/mL
iii. CTGrade rh IL-21:10 ng/mL 和 20 ng/mL
iv. 在IL-21条件下添加200 IU/mL CTGrade GMP rh IL-2C126S。因为IL-21是一种辅助细胞因子,无法单独支持良好的T细胞扩增。
b. 各条件下的每个孔板设3个培养复孔,培养体积为7 mL
c. 每个时间点9个孔板(3个供体和3种细胞因子,共9个孔板)
d. day3的孔板无需更换培养基
e. day7和day10的孔板各更换1次培养基(每孔5.25 mL)
f. 每个条件所需的培养基总体积:
[3 plates×(3 wells×7 mL/well)+6 plates×(3 wells×(7 mL/well+5.25 mL/well))]×3 donors=724 mL per condition
2. 为各批次准备750 mL的PRIME-XV T Cell CDM,并且含有的每种细胞因子各准备2种浓度。
误差范围的额外体积
接种细胞
3. 计算每个供体所需的细胞数量
a. 接种密度 = 5×105 cells/cm2
b. 每孔板24孔
c. 每个供体9个孔板(3个时间点,3 种细胞因子)
5×105 cells/cm2×2 cm2/well×24 wells/plate×9 plates/donor=2.16×108 cells/donor
4. 根据试验方案使用Dynabeads激活每个供体的2.16×108 cells
2.16×108 cells×1 Dynabead/cell×1 mL/4×107 Dynabeads = 5.4 mL Dynabeads per donor
5. 使用Dynabeads激活后,将每个供体重悬于9.6 mL PRIME-XV T Cell CDM(不含CTGrade GMP rh IL-2C126S)中,
并用移液管充分轻吹混匀,以形成均匀的细胞悬液。
6. 将100 μL细胞悬液等量分装至每个供体的9个24孔G-Rex板的每个孔中。
7. 从步骤2的培养基中取7 mL添加至每个孔板相应的孔中,并在标准的组织培养条件下进行培养。
细胞收集和分析
8. 在适当的时间点进行补料添加和细胞收集
a. 收集day3孔板中的细胞并计数,使用PBMC流式细胞仪面板进行染色
b. 在第5天时对day7、day10的孔板进行补料添加,从每个孔中吸出5.25 mL培养基,更换为5.25 mL的新鲜细胞因子补充培养基。
c. 收集day7孔板中的细胞并计数,使用PBMC流式细胞仪面板进行染色
9. 在实验的最后一天收集day13孔板中的细胞,并将细胞群分成3组:用于计数的细胞、用于表面染色的细胞以及用于功能测试和细胞内染色的细胞。
a. 与之前的时间点相同,对细胞进行计数和表面标记染色
10. 准备进行功能测试
a. 将约2×106 cells/well分别加入96孔圆底有盖板中(其中一个将作为未刺激的对照组)
b. 对两个孔板进行CD107a染色
c. 用葡萄球菌肠毒素 B (SEB) 刺激其中一个孔板
d. 在标准组织培养条件下,将两个孔板孵育2 h
e. 在两个孔板中加入蛋白转运抑制剂,并孵育4 h
11. 开始进行细胞内染色
a. 固定和渗透细胞
b. 对细胞进行细胞内标记和细胞因子染色
c. 启动流式细胞仪
结果
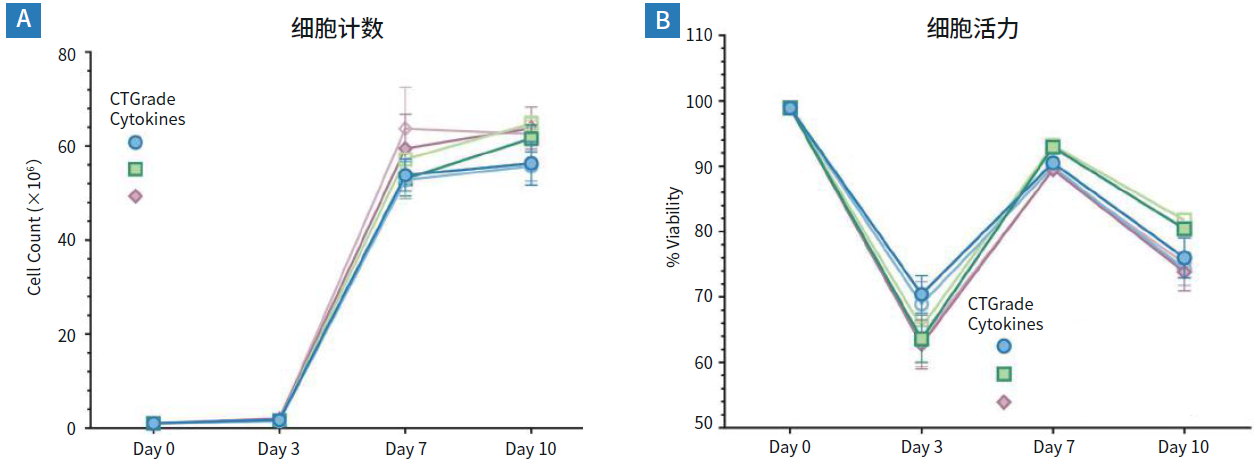
图1. 在添加CTGrade GMP rh IL-7、IL-15 或 IL-21 + IL-2C126S的PRIME-XV T Cell CDM中,新鲜人PBMC表现出强劲的扩增能力和高存活率。
(A)day10时,所有含CTGrade GMP rh IL的条件都出现相当水平的扩增,在较低浓度的CTGrade GMP rh IL-7和rh IL-15条件下的扩增略低(未显示)。
(B)细胞活力下降的原因通常是活化诱导的细胞凋亡,这一情况在day7完全恢复。整个培养过程中的细胞存活率均保持在75%以上,所有浓度和来源的白细胞介素都同样对细胞存活有着正面影响。
以上结果是3个供体、3个批次、2种不同浓度的CTGrade GMP rh IL-7、IL-15 和 IL-21在各条件下的三重试验结果。
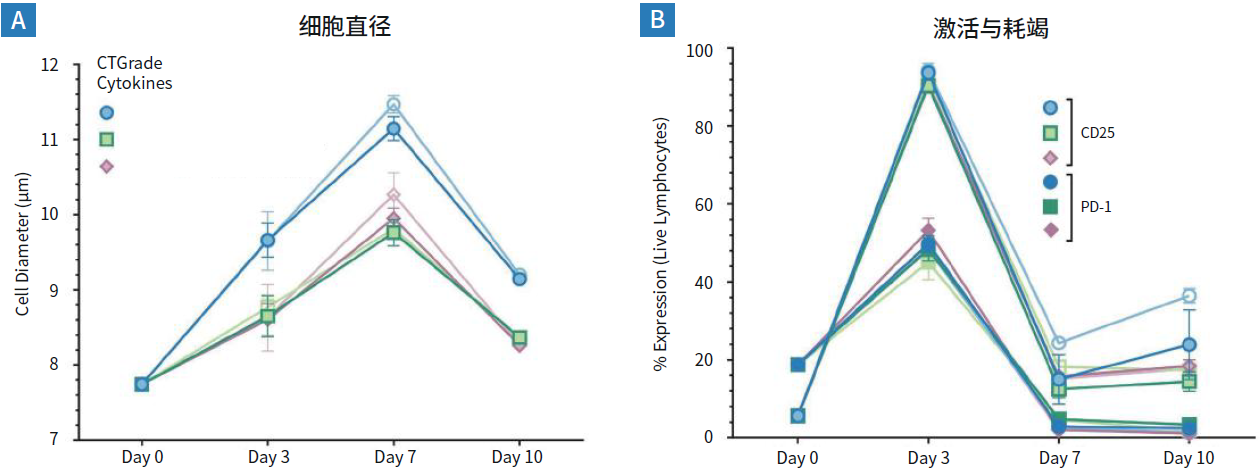
图2. 新鲜人PBMC在添加CTGrade GMP rh IL-7、IL-15或IL-21 + IL-2C126S的 PRIME-XV T Cell CDM 中显示出健康的活化动力学。
(A)在含有IL-7的条件下,激活后细胞直径的增加更为明显,但在其他条件下也遵循预期的动力学。
(B)细胞活力在day3下降的同时,PD-1也在增加,直到扩增后的day7,PD-1已降至可以忽略不计的水平。活化标记物CD25在扩增后第一周结束时下降,并在day10保持稳定。以上结果是3个供体、3个批次、2种不同浓度的CTGrade GMP rh IL-7、IL-15 和 IL-21在各条件下的三重试验结果。
| |
| 图 3. 细胞在整个扩增过程中保持辅助细胞与细胞毒性细胞的生理相关比例,CTGrade GMP rh IL-2C126S是响应超抗原刺激的必要条件。 在完全使用 CTGrade GMP rh IL-7或IL-15的条件下,(A)CD4+和(B)CD8+免疫调节细胞因子的基线表达较高。只有含CTGrade GMP rh IL-2C126S的条件在超抗原刺激后才显示出功能标志物的上调。(C)虽然CD4+︰CD8+比率在培养中期下降,但在day10时又部分恢复,这表明两个T细胞亚群都仍存活并持续增殖。结果代表了 3 个供体、3 个批次、2 种不同浓度的 CTGrade GMP rh IL-7、IL-15 和 IL-21 在各条件下的三重试验结果。 |
讨论
尽管具体结果会因供体之间的差异而有所不同,但 CTGrade rh GMP IL-2C126S在所有测试浓度下都能支持 PRIME-XV T Cell CDM中T细胞的活化和大幅扩增。在进行超抗原刺激时,结果细胞显示出较小的衰竭标记和强大的活性,同时还保持着与生理相关的CD4+︰CD8+比率。CTGrade GMP rh IL-2C126S与PRIME-XV T Cell CDM的结合为健康的T细胞提供了一个化学定义上不含动物源成分的环境,这大大减少了细胞疗法生产过程中的变数、未知污染物和下游应用于人体的风险。
在 PRIME-XV T Cell CDM中,CTGrade GMP rh IL-7和IL-15以两种测试浓度单独使用时可支持各种供体T细胞的大幅扩增,而在结合使用CTGrade GMP rh IL-21和IL-2C126S时也能观察到类似的扩增。扩增后的细胞显示出最小的衰竭标记和健康的活化动力学,同时保持着与生理相关的CD4+︰CD8+比率。虽然在CTGrade GMP rh IL-7或IL15中单独扩增的细胞对超抗原刺激没有明显的反应,但这些细胞因子在各种组合中的互补作用已得到证实,可根据具体应用进行研究。尽管供体与供体之间的差异会导致具体结果的变化,但CTGrade GMP rh IL-7、IL-15和IL-21与PRIME-XV T Cell CDM一同为细胞疗法所用的健康T细胞的活化和扩增提供了一种独立于化学定义且不含动物源成分的重组人IL-2C126S,使用这些重组蛋白大大减少了生产过程中的变量、未知污染物以及下游应用于人体的风险。
点击此处下载PDF:在G-Rex细胞培养系统中使用PRIME-XV T Cell CDM和CTGrade重组人蛋白扩增PBMC |
点击此处查看相关产品:PRIME-XV T CELL CDM
点击此处查看相关产品:Shenandoah CTGrade重组蛋白系列
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |