外泌体分离和纯化试剂盒![]()
MagCapture™ Exosome Isolation Kit PS Ver.2
使用磷脂酰丝氨酸和Tim4的新型外泌体纯化法:PS亲和法
外泌体膜含有分泌细胞来源蛋白质和脂质,其中,磷脂酰丝氨酸(PS),目前普遍认为在活细胞中通过脂质翻转酶的作用定位于细胞膜内侧,但是,它也暴露在外泌体膜的外侧3)。Tim4(T-cell immunoglobulin domain and mucin domain-containing protein 4)是凋亡细胞的巨噬细胞吞噬受体。在钙离子存在下,Tim4通过与胞外区的IgV结构域结合到PS 4)。
以上述知识作为参考,我们利用Tim4固化磁珠,在钙离子存在下捕获培养上清和血清等样品中的外泌体,并通过添加螯合剂即可纯化外泌体,这种划时代的外泌体纯化方法是由FUJIFILM Wako和金泽大学纳米生命科学研究所的华山教授共同开发并取得了成功5)。
与传统的外泌体纯化法相比,外泌体纯化试剂盒“MagCapture™ Exosome Isolation Kit PS Ver.2”可实现更加简单地纯化完整状态的高纯度外泌体。这是可取代迄今为止的黄金标准法超速离心法的新型外泌体纯化法。
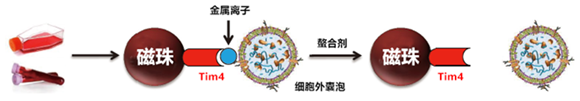
利用磷脂酰丝氨酸(PS)结合分子以金属离子依赖性方式捕获细胞外囊泡,并通过螯合剂洗脱。
◆利用PS亲和法提取和分离细胞外囊泡(外泌体)
采用新型亲和纯化法 ● 使用PS亲和分子回收※ ● 低背景 ● 在中性条件下利用螯合剂温和洗脱
分离高纯度完整的外泌体 | 无需进行超速离心 ● 使用磁珠提高操作性 ● 优化实验protocol
实验再现性高 |
和其他纯化方法的比较
方法 | 纯度 | 外泌体回收量 | 获得完整粒子 | 总蛋白量 |
MagCapture™(PS亲和法) | ■ ■ ■ ■ | ■ ■ ■ | ○ | ■ |
超速离心法 | ■ ■ | ■ ■ | ○ | ■ ■ ■ |
聚合物沉淀法 | ■ | ■ ■ | ○ | ■ ■ ■ ■ |
密度梯度离心法 | ■ ■ ■ | ■ | ○ | ■ ■ |
尺寸排阻法 | ■ ■ ■ | ■ ■ | ○ | ■ ■ |
表面抗原亲和法 (使用抗体) | ■ ■ ■ | ■ ■ | × | No data |
※ 本表格根据FUJIFILM Wako自行调查的结果制成。表中结果可能因样品、检测对象与方法的不同而有所差异,无法保证以上各方法的性能。
◆MagCapture™ Exosome Isolation Kit PS Ver.2
MagCapture™ 外泌体提取试剂盒PS Ver.2:PS亲和法x磁珠
该试剂盒可从细胞培养上清、血清、血浆等样品中高纯度且简便快捷地纯化外泌体等细胞外囊泡。通过应用以钙离子依赖方式与细胞外囊泡表面的磷脂酰丝氨酸(PS)结合的Tim4,并使用螯合剂实现完整的细胞外囊泡纯化。
特点
● 通过新型亲和法(PS亲和法)可获得高纯度的细胞外囊泡
● 与传统的超速离心法相比,可获得更高回收量和纯度的外泌体
● 可获得完整的外泌体,应用广泛
● 磁珠操作简便,可处理多个样品
操作流程
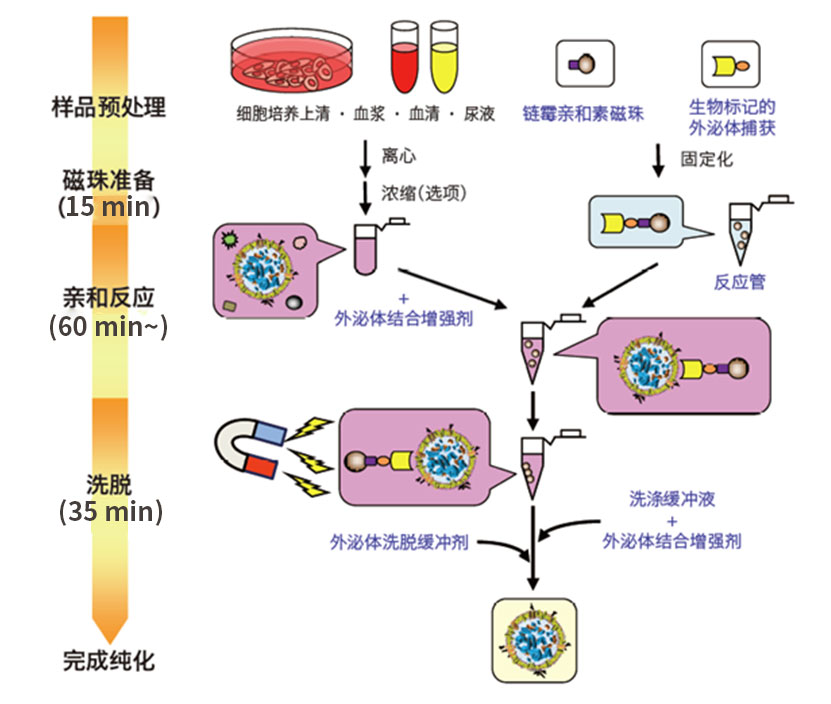
试剂盒组成
2 tests | 10tests | |
Biotin Capture Magnetic Beads | 120 μL | 600 μL |
Biotin-labeled Exosome Capture | 20 μL | 100 μL |
Exosome Immobilizing / Washing Buffer (10×) | 5 mL | 25 mL |
Exosome Binding Enhancer (500×) | 300 μL | 1500 μL |
Exosome Elution Buffer (10×) | 300 μL | 1500 μL |
Reaction Tubes | 4支 | 22支 |
◆PS亲和法提取纯化外泌体的应用数据合集
4. 健康人血清来源外泌体的miRNA和mRNA的回收量比较
6. 使用Protein Assay BCA Kit定量外泌体的蛋白浓度
1. 从培养上清样品纯化的细胞外囊泡的性能数据
使用透射电子显微镜对PS亲和法和超速离心法分离的外泌体进行分析。
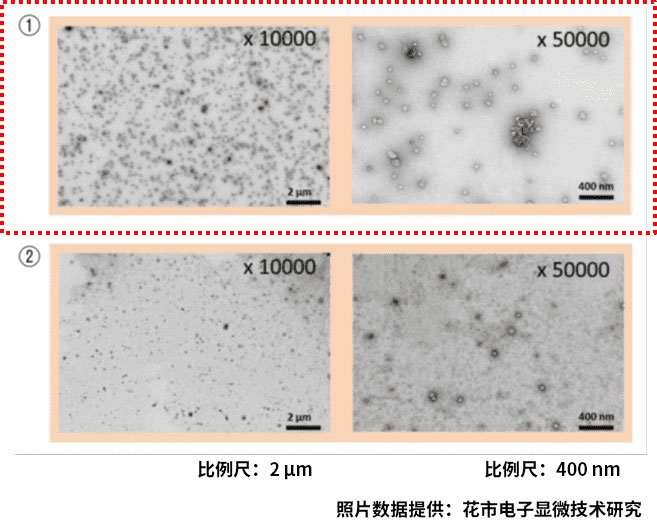
①本试剂盒纯化的样品
粒子数:3.69×1010 particles/mL
②超速离心法纯化的样品
样品:COLO201细胞培养上清10 mL
粒子数:1.68×1010 particles/mL
与超速离心法相比,PS亲和法分离的外泌体可观察到多约100 nm的囊泡,且杂质少。
2. 从血清、血浆、尿液样品纯化的细胞外囊泡的性能数据
从人血清提取的外泌体回收量比较
使用本试剂盒、超速离心法和表面抗原抗体亲和法从1 mL的人血清样品中提取外泌体,并进行Western blot(抗CD9抗体和抗CD63 抗体)。
| 泳道1:超速离心法 泳道2:PS亲和法 泳道3:A公司外泌体提取试剂盒(CD9) 泳道4:A公司外泌体提取试剂盒(CD63) 泳道5:A公司外泌体提取试剂盒(CD81) 泳道6:A公司外泌体提取试剂盒(CD9、CD63、CD81和EpCAM抗体磁珠混合物) |
WB数据:每个样本结果对应150 μL的血清样品。从100 μL提取物中取出15 μL,添加5μL的 4×SDS样品缓冲液,全部上样。
结果:与超速离心法和抗体亲和法相比,PS亲和法的外泌体回收率更高。
从人EDTA血浆样品中分离外泌体
分别从1mL的EDTA血浆、EDTA血浆(超滤更换缓冲液)、人血清中样品中提取外泌体,并进行Western blot (抗 Flotillin2 抗体)。
| 泳道1:EDTA血浆 泳道2:EDTA血浆(超滤更换缓冲液) 泳道3:血清 检测抗体:抗Flotillin-2小鼠单抗(29/Fotillin-2),BD Bioscience 使用样品量:各1mL WB数据:每个样本结果对应150 μL血清样品。从100 μL提取物中取出15 μL,添加5μL的4×SDS样品缓冲液,全部上样。 结果:通过超滤更换缓冲液后,可以更高效地回收外泌体。 |
从人尿液样品中分离的外泌体回收量比较
使用本试剂盒、聚合物沉淀法和超速离心法从1 mL尿液样品中提取外泌体,并进行Western blot。
标记蛋白回收量比较
| 泳道1:聚合物沉淀法 泳道2:超速离心法 泳道3:PS亲和法
检测抗体:抗 CD9 兔多抗(System Biosciences) 使用样品量:各1mL WB数据:每个样本结果对应150 μL尿液样品。从100 μL提取物中取出15 μL,添加5μL的 4×SDS 样品缓冲液,全部上样。 |
|
|
|
Size Distribution Mean: 176 +/- 1.6 nm | Size Distribution Mean: 191 +/- 9.4 nm | Size Distribution Mean: 107 +/- 1.2 nm |
结果:从尿液样品中也可以高纯度提取外泌体。
3. 与传统沉淀法的性能比较
分别用本试剂盒、超速离心法和聚合物沉淀法从K562(人慢性骨髓性白血病)细胞培养上清(无血清培养上清或 10% Exosome-depleted FBS 添加培养基)提取外泌体,比较三种方法的外泌体回收量和外泌体纯度。
PS 亲和法:按照试剂盒的Protocol(反应时间:3 h),从1 mL经离心处理(10,000×g,30 min)的 K562 细胞培养上清(无血清培养基或 10% Exosome-depleted FBS 添加培养基)中提取外泌体。
超速离心法:将10 mL经过离心处理(10,000×g,30 min)的K562细胞培养上清(无血清培养基或 10% Exosome-depleted FBS 添加培养基)进行超离(110,000×g,70 min),用TBS缓冲液重悬沉淀物后,再进行超离(110,000×g,70 min),回收沉淀部分。
聚合物沉淀法:从1 mL经过离心处理(10,000×g,30 min)的 K562 细胞培养上清(无血清培养基或 10% Exosome-depleted FBS 添加培养基)中,按照市售的A公司产品的操作说明(静置时间:过夜)提取外泌体。
比较提取的外泌体的电子显微镜分析结果和纳米粒子追踪(NTA)分析结果
分别用本试剂盒、超速离心法和聚合物沉淀法从K562细胞培养上清提取外泌体,用NTA LM-10 检测外泌体的粒子直径。另外,用最终浓度为2%的多聚甲醛固定提取到的外泌体(2~4×1010 particles),使用电子显微镜进行分析。
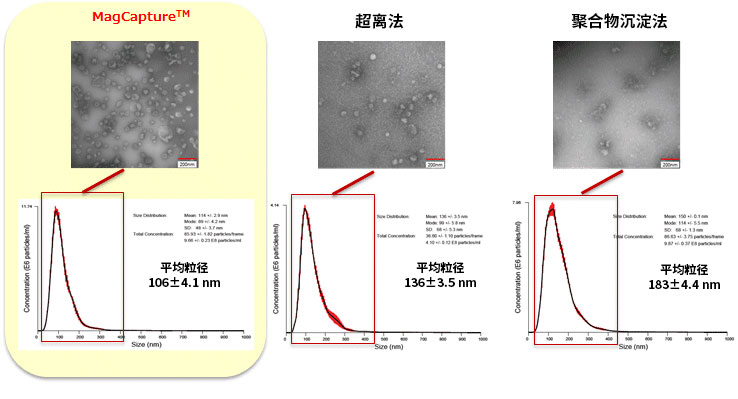
电子显微镜图像 数据提供:金泽大学 医学系 华山教授、大阪大学 iFReC 中井先生
结果:MagCapture™(PS亲和法)可提取约100 nm 的粒子,在电子显微镜中也可以确认到大量的细胞外囊泡。
K562细胞培养上清(无血清培养基)提取的外泌体回收量和纯度的比较
使用本试剂盒、超速离心法和聚合物沉淀法从K562细胞培养上清(无血清培养基)提取外泌体并进行电泳,再使用银染色和 WB 法(抗CD63抗体、抗Flotilin-2抗体和抗Lamp-1 抗体)进行检测。
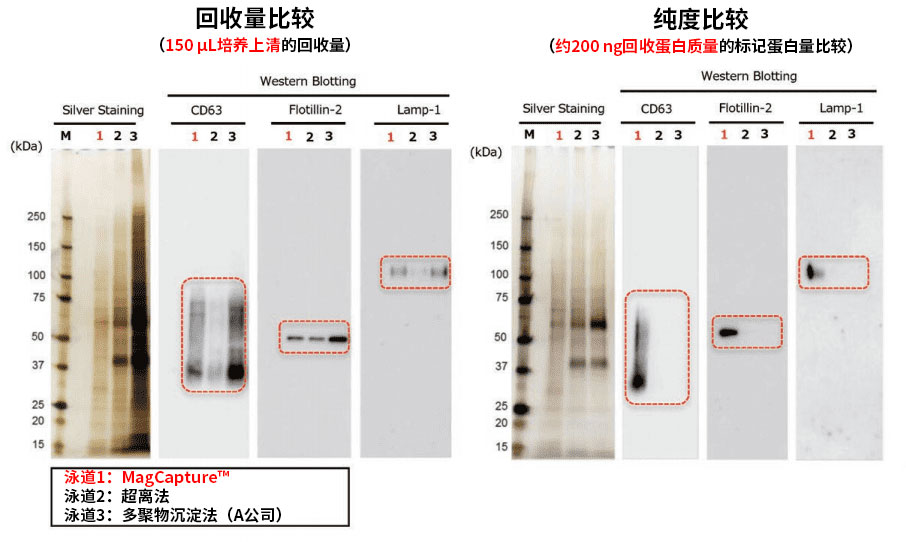
结果:银染色结果显示,与MagCapture™(PS亲和法)相比,超速离心法和聚合物沉淀法可提取更多外泌体。但是,WB法显示,只有MagCapture™ 外泌体提取试剂盒可检测外泌体标记蛋白条带。
由此可知,MagCapture™ 外泌体提取试剂盒可提取更高纯度的外泌体。
K562细胞培养上清(10% FBS添加培养基)提取外泌体的回收量和纯度的比较
使用本试剂盒 、超速离心法和聚合物沉淀法,从K562细胞培养上清(10%去外泌体FBS 添加培养基)提取样品进行电泳,再用银染法和WB法(抗CD63抗体、抗Flotilin-2抗体和抗Lamp-1 抗体)进行检测。同时,对外泌体提取片段进行质谱分析,比较所有分析的多肽中K562细胞来源的人多肽的比例(添加至培养基的FBS来源牛蛋白聚集体混入,会导致人来源多肽比例下降)。
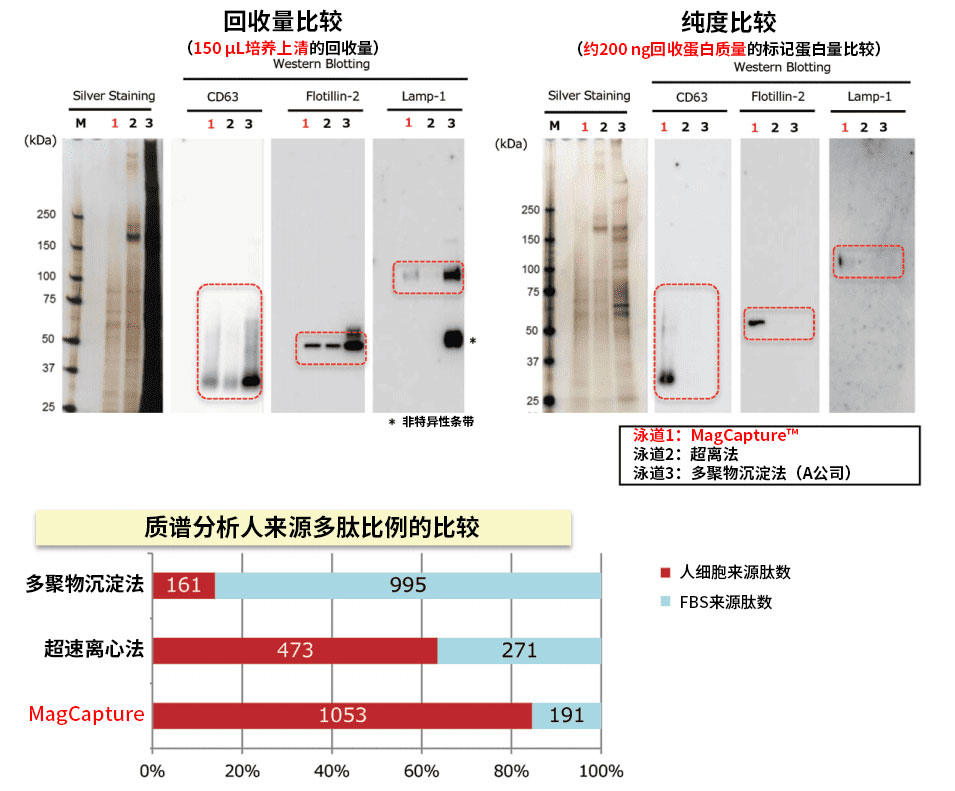
质谱分析 数据提供:金泽大学 医学系 华山教授、大阪大学 iFReC 中井先生
结果:使用MagCapture™(PS亲和法)可从FBS培养基中提取高纯度外泌体,因此在低背景时也可进行质谱检测。
4. 健康人血清来源外泌体的miRNA和mRNA的回收量比较
比较从不同方法制备的外泌体中microRNA和mRNA的回收量
使用超离法和PS亲和法从健康人血清中分离外泌体后,再使用microRNA 提取试剂盒(产品编号295-71701)提取RNA。通过定量PCR法比较microRNA量(let-7a, miR-16, miR-92a, miR-142-3p)和mRNA量(GAPDH, PIK3CB)的Ct 值。
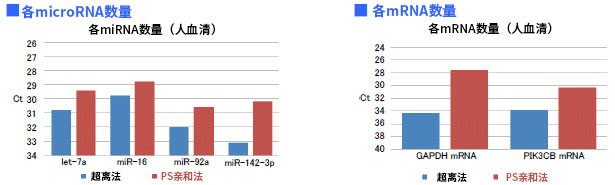
结果:与超离法相比,PS亲和法提取外泌体中的microRNA和mRNA的效率更高。
使用PS亲和法从健康人血清中分离外泌体,再使用 microRNA 提取试剂盒(产品编号295-71701)或使用AGPC 法提取RNA。通过定量PCR法比较microRNA量(let-7a, miR-16, miR-92a, miR-142-3p)和mRNA量(GAPDH, PIK3CB)的Ct值。
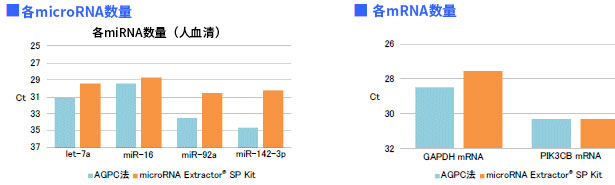
结果:与AGPC法相比,使用microRNA提取试剂盒提取外泌体中的microRNA和mRNA的效率更高。
5. 外泌体的蛋白质组学分析
实验内容和结果
分别使用PS亲和法、超离法和聚合物沉淀法,从K562细胞培养上清(添加10%去外泌体FBS的培养基)中纯化外泌体。纯化的样品通过 10% SDS-PAGE电泳分离,切下全部蛋白条带。然后进行胶内消化,用液相色谱质谱(LC-MS)鉴定蛋白。比较上述三种方法纯化的外泌 体(n=3)中检测蛋白的成对相关性。
鉴定的蛋白含量前10的蛋白
白色柱:外泌体来源人蛋白
灰色柱:牛血清来源牛蛋白
红 色:外泌体标记蛋白
样品:K562 细胞培养上清(10%已去除外泌体的培养基)
PS亲和法 | 超离心 | 聚合物沉淀法 | |
1 | 71 kDa热休克同源蛋白 (Heat shock cognate 71kDa protein) | DNA依赖蛋白激酶催化亚基基因 (DNA-dependent protein kinase catalytic subunit) | 补体C3 (Complement C3) |
2 | 膜联蛋白A6 (Annexin A6) | 铁转蛋白受体1 (Transferrin receptor protein1) | α2-巨球蛋 (Alpha-2-macroglobulin) |
3 | 铁转蛋白受体1 (Transferrin receptor protein1) | 血清白蛋白 (Serum albumin) | 纤连蛋白 (Fibronectin) |
4 | V-ATP酶A亚基 (V-type proton ATpase catalytic subunit A) | ATP依赖RNA解旋酶 (ATP-dependent RNA helicase A) | 血清白蛋白 (Serum albumin) |
5 | 浮舰蛋白-2 (Flotillin-2) | 微管蛋白β5 (Tubulin beta-5 chain) | 血小板反应蛋白-1 (Thrombospondin-1) |
6 | 程序性细胞死亡6互作蛋白 (Programmed cell death 6-interacting protein) | 71 kDa热休克同源蛋白 (Heat shock cognate 71 kDa protein) | 补体C4 (Complement C4) |
7 | 细胞表面抗原4F2重链 (4F2 cell-surface antigen heavy chain ) | 脂肪酸合成酶 (Fatty acid synthase) | α-1抗蛋白酶 (Alpha-1-antiproteinase) |
8 | 膜联蛋白A1 (Annexin A1) | 细胞表面抗原4F2重链 (4F2 cell-surface antigen heavy chain) | 载脂蛋白-β-100 (Apolipoprotein-β-100) |
9 | 220kDa激酶D相互作用底物 (Kinase D-interacting substrate of 220kDa) | U5小核核糖核蛋白的解旋酶 (U5 small nuclear ribonucleoprotein helicase) | 胎儿血红蛋白亚单位 (Hemoglobin fetal subunit beta) |
10 | 膜联蛋白A2 (Annexin A2) | β4微管蛋白 (Tubulin beta-4B chain) | β5微管蛋白 (Tubulin beta-5 chain) |
结果:聚合物沉淀法中混入了牛血清来源蛋白,与之相比,PS亲和法检测出了更多的标记蛋白。
| 样品:K562细胞培养上清(10% 去外泌体FBS培养基)
|
同种方法的相关性:PS亲和法和聚合物法较高,超离法稍低,
不同方法的相关性:较低,各种提取方法获得的外泌体亚群可能不同。
6. 使用Protein Assay BCA Kit定量外泌体的蛋白浓度
Protein Assay BCA Kit 是使用二辛可宁酸(BCA)定量检测溶液中蛋白质浓度的试剂盒,是蛋白质定量检测法中常用的方法。其原理为,碱性条件下的蛋白质Cu2+ 离子被还原为Cu+。Cu+与BCA形成络合物,产生紫色螯合物,紫色螯合物颜色与蛋白质浓度相关,因此通过测定562 nm 处的吸光度,并与标准曲线进行比较,即可定量溶液中的蛋白质浓度。
使用MagCapture™ 外泌体提取试剂盒(PS亲和法)从细胞培养上清中提取外泌体,并通过Protein Assay BCA Kit高灵敏检测外泌体中的蛋白质浓度。
实验内容及结果
将MagCapture™ 外泌体提取试剂盒(PS亲和法)提取的25 μL外泌体溶液分注于96孔板中,添加200 μL的Protein Assay BCA Kit 中试剂A和试剂B的混合液。然后60℃孵育30 min,检测560 nm 处的吸光度(图1)。结果表明,通过 Protein Assay BCA Kit 的高灵敏度检测,可检测纯化外泌体中的蛋白质浓度。
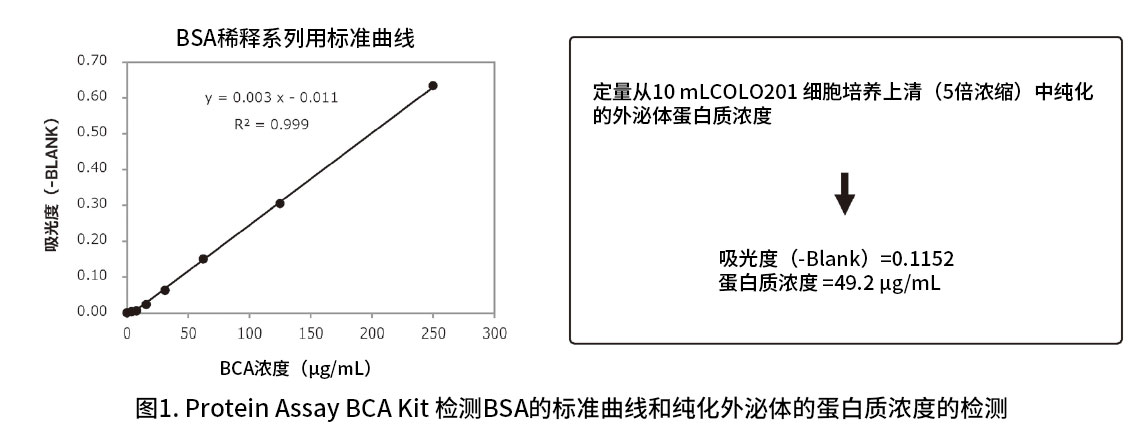
外泌体蛋白质浓度非常低,因此BCA检测时无需稀释样品。
①将 BSA 标准溶液按照 250、125、62.5、31.25、15.625 μg/mL 和空白对照,分别每孔 25 μL添加至96 孔板中。
②分别把纯化的外泌体和洗脱缓冲液(空白)按照每孔 25 μL添加至96 孔板。
③将200 μL Protein Assay BCA Kit(产品编号:297-73101)的试剂A和试剂B混合液(A﹕B=50﹕1)添加至孔板中。
④60℃孵育30 min。
⑤室温下冷却孔板。
⑥检测560 nm处的吸光度。
7. 外泌体的标记和Hela细胞摄入实验
实验概要
使用PKH67(Sigma)标记 MagCapture™ 外泌体提取试剂盒(PS亲和法)纯化的外泌体,确认是否可导入Hela 细胞。
PKH67标记外泌体
1. MagCapture™ 外泌体提取试剂盒(PS亲和法)纯化外泌体(实验当天从COLO201细胞培养上清中纯化外泌体)。
※ 在步骤6-7的凝胶过滤步骤中,为了减少标记样品的吸附损失,建议向试剂盒附带的洗脱液中添加EV-Save™ Extracellular Vesicle Blocking Reagent来制备样品。
2. 用BCA Assay和NanoSight检测样品的蛋白质浓度和粒子浓度。
3. 将外泌体样品溶液分装至1.5 mL管中。
※ 本次使用相当于3 μg蛋白量的外泌体,请制备标记所需的外泌体量。
4. 将2.0 μL的PKH linker 溶解在0.25 mL 的 DiluentC (PKH67试剂盒随附)中。…4×Dye solution※
※ 请制备标记所需的使用量。
5. 添加1/3样品量的4×Dye solution至样品中,混合后在室温中孵育 5-10 min。
6. 根据随附的使用说明书用PBS平衡 Exosome Spin Columns (MW 3000)(Thermo :#4484449)。
7. 将100 μL样品分别添加至上述平衡后的旋转柱※中,750×g离心2 min。
※ 旋转柱的最大添加量为100 μL,因此样品量超过100μL时请准备所需支数。
8. 将外泌体溶液※添加至已经接种好Hela细胞的培养皿中,24 h后用显微镜观察并利用流式细胞仪进行分析。
※ 根据实验调节外泌体添加量
显微镜观察结果 | 流式细胞仪分析结果 |
|
|
图1. PKH67标记外泌体的摄入观察
关于使用MagCapture™ 外泌体提取试剂盒(PS亲和法)分离COLO201来源外泌体样品(总蛋白量3 μg,粒子数1×1010个),使用PKH67 Green Fluorescent Cell Linker Kit (Sigma)进行标记后,可在荧光显微镜(左)和流式细胞仪(右)中确认到Hela细胞的摄入。
结果:在显微镜和流式细胞仪中都能可确认PKH67标记的外泌体通过胞吞作用被捕获。此外添加EV-Save™ Extracellular Vesicle Blocking Reagent的样品在去除Dye时,可极大减少凝胶过滤的吸附损失。
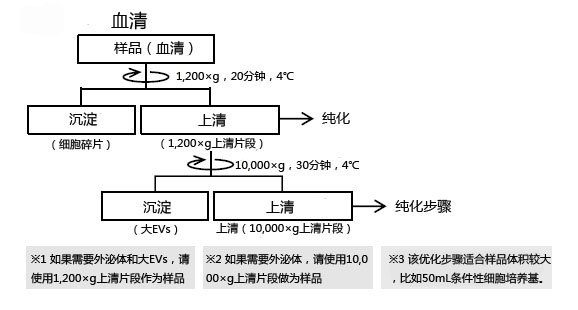
◆各样品的前处理Protocol
本流程是样品前处理的步骤。想提取外泌体和其他细胞外囊泡(微泡)时,请按照下述Protocol对样品进行 1,200×g 离心操作※1,如果要提取更高纯度的外泌体,则按照下述Protocol对样品进行10,000×g 离心操作※2。
下文是细胞培养上清、血清/血浆的前处理方法。其他体液样品的前处理操作,请参考血清/血浆的Protocol,进行适当调整。
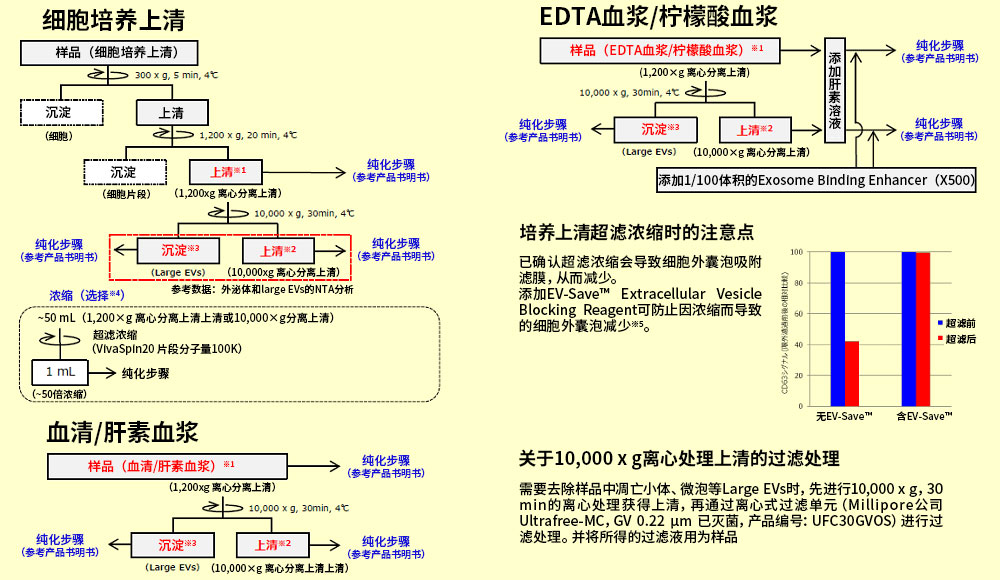
※1 提取外泌体+Large EVs时,请使用1,200xg上清作为纯化用样品。
※2 提取外泌体时,请使用10,000xg上清作为纯化用样品。
※3 提取Large EVs时,将10,000xg 离心所得的沉淀,用TBS重悬后作为样品。
※4 浓缩步骤是以大规模(~50 mL)的细胞培养上清作为纯化用样品,是选择性的操作步骤。但由于该步骤可提高回收效率,因此请尽可能进行该步骤。
※5 EV-Save™ 含有聚合物,因此不建议用作蛋白质组学分析的样品。
大量或少量样品时的注意点
大量样品
从大规模(~50 mL)的细胞培养上清中纯化外泌体时,推荐浓缩操作。因其可提高回收效率,,请尽可能进行该操作。
少量样品
样品体积低于0.5 mL时,使用旋转装置无法有效混匀Exosome Capture固化磁珠和样品,因此请根据需求添加TBS缓冲液,将样品体积扩增至0.5 mL以上。(例:100 〜200 μL → 500 μL)
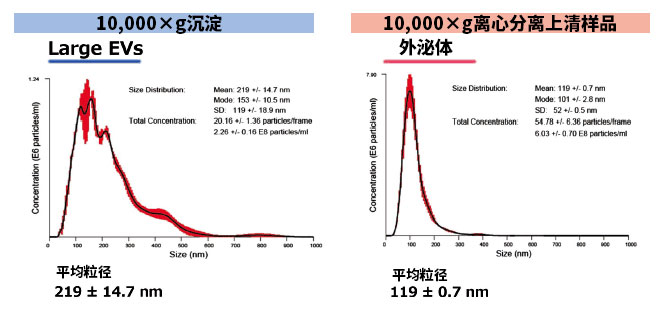
参考数据:外泌体和Large EVs的NTA分析
准备了1 mL用莫能菌素钠促进外泌体分泌的K562细胞培养上清,并从中制备10,000 x g离心后的上清样品和10,000 x g沉淀样品(使用1 mL TBS重悬)。
再使用MagCapture™ 外泌体提取试剂盒从两个样品中纯化细胞外囊泡,并进行NanoSight LM10分析。
◆Ver.2和旧款的不同
MagCapture™ 外泌体提取试剂盒Ver.2(产品编号:290-84103)は、MagCapture™ 外泌体提取试剂盒(产品编号:293-77601,旧款)的改良版。
1. 外泌体回收效率提高
→相同操作下,可提取更多的外泌体!
2. 可大幅度缩短操作时间
→1 h即可完成和样品的亲和反应!(旧款需要3 h)
3. 改善细胞毒性
→降低洗脱缓冲液的细胞毒性
试剂盒 | MagCapture™ 外泌体提取试剂盒Ver.2 | (旧款)MagCapture™ 外泌体提取试剂盒 |
外泌体提取性能 | 培养上清:■■■■ 血液样品:■■■■ | 培养上清:■■■ 血液样品:■■■ |
样品反应时间※1 | 1 h以上 | 3 h以上 |
磁珠可再利用次数※2 | 5次 | 5次 |
洗脱缓冲液的细胞毒性 | 低※3 | 因细胞种类不同 |
※1 因样品体积而异。
※2 使用总次数设定为5次,包括首次使用1次,重复使用4次。提取样品的来源不同,考虑污染风险时,推荐使用新调配的磁珠。
※3 请勿更换洗脱样品的缓冲液,可用于In Vitro和In Vivo的给药实验。洗脱缓冲液的EDTA出现问题时,需要更换缓冲液。
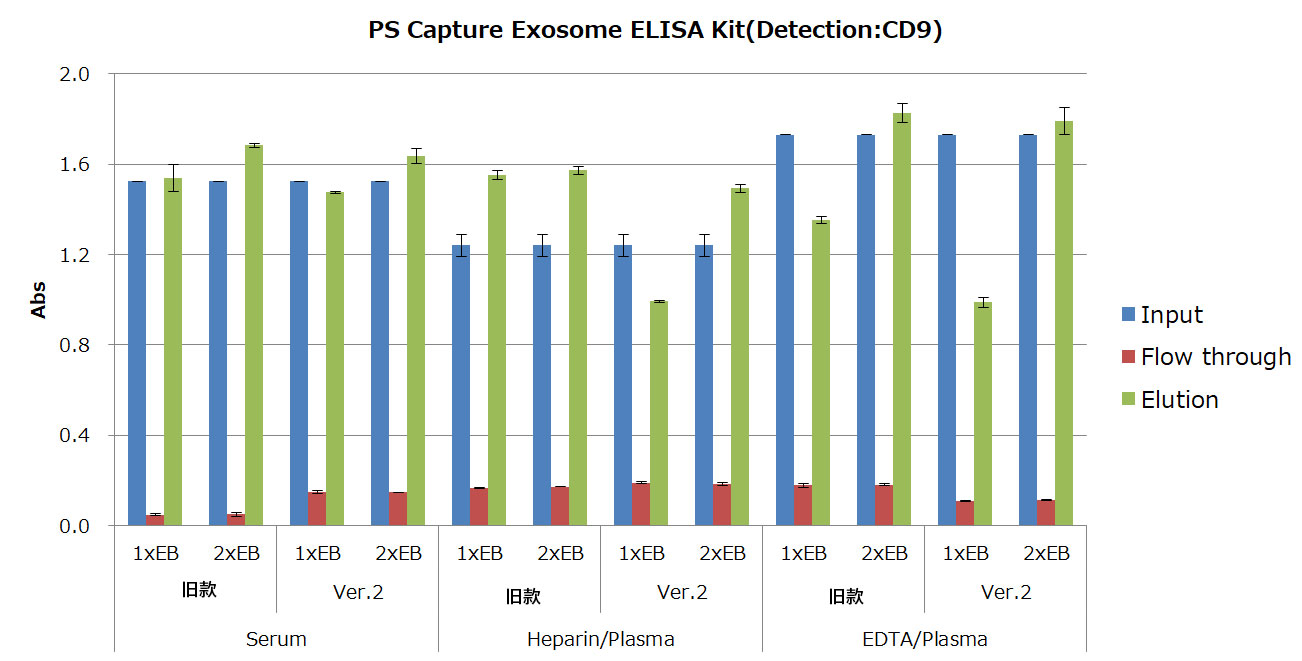
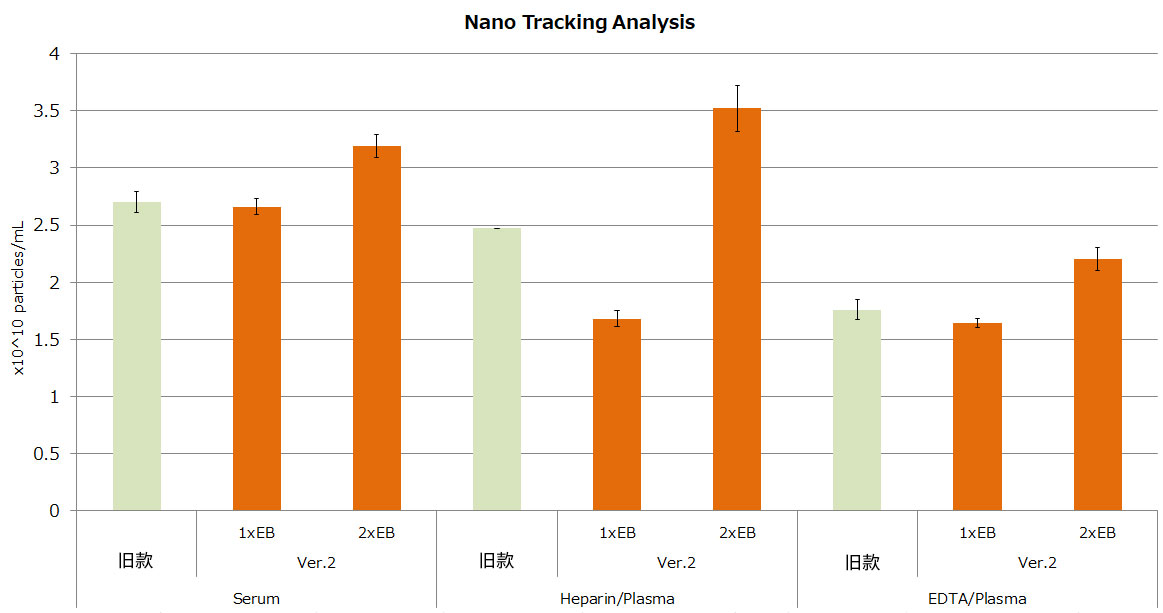
1. 外泌体的回收率比较(血清和血浆)
使用MagCapture™外泌体提取试剂盒Ver.2(产品编号:290-84103)和旧款试剂盒从各种人血液样品中分离纯化外泌体(EV)。对获得的外泌体,
①使用PS Capture™外泌体ELISA试剂盒比较EV标志物
②通过Western blot比较EV标志物
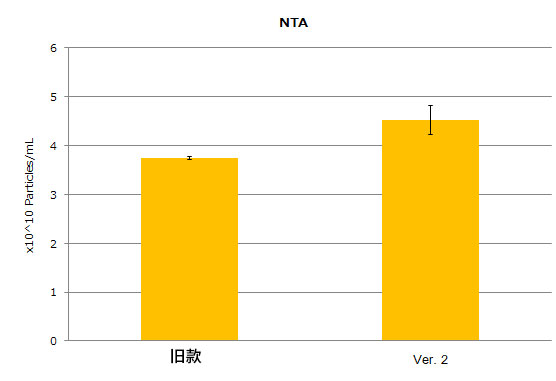
③通过NTA进行粒子数测定
再将试剂盒附带的洗脱缓冲液按照常规的Protocol稀释成“1x Elution buffer(1xEB)”,并和5倍稀释的“2xElution buffer(2xEB)”进行比较。
结果显示,Ver.2试剂盒表现出与旧款试剂盒相当或更优的性能。特别是使用2xElution Buffer时,血浆样品的回收效率显著提升。
①使用PS Capture™外泌体ELISA试剂盒比较EV标志物
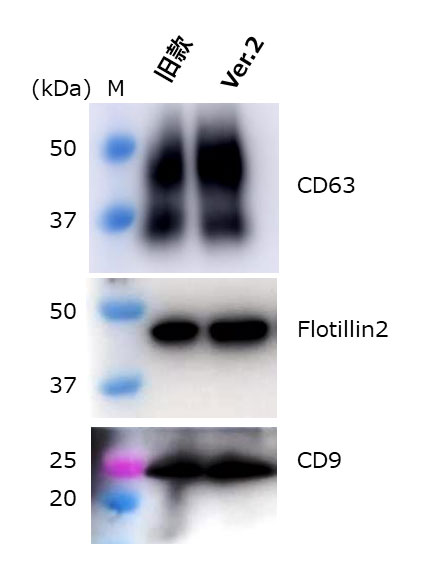
②通过Western blot比较EV标志物
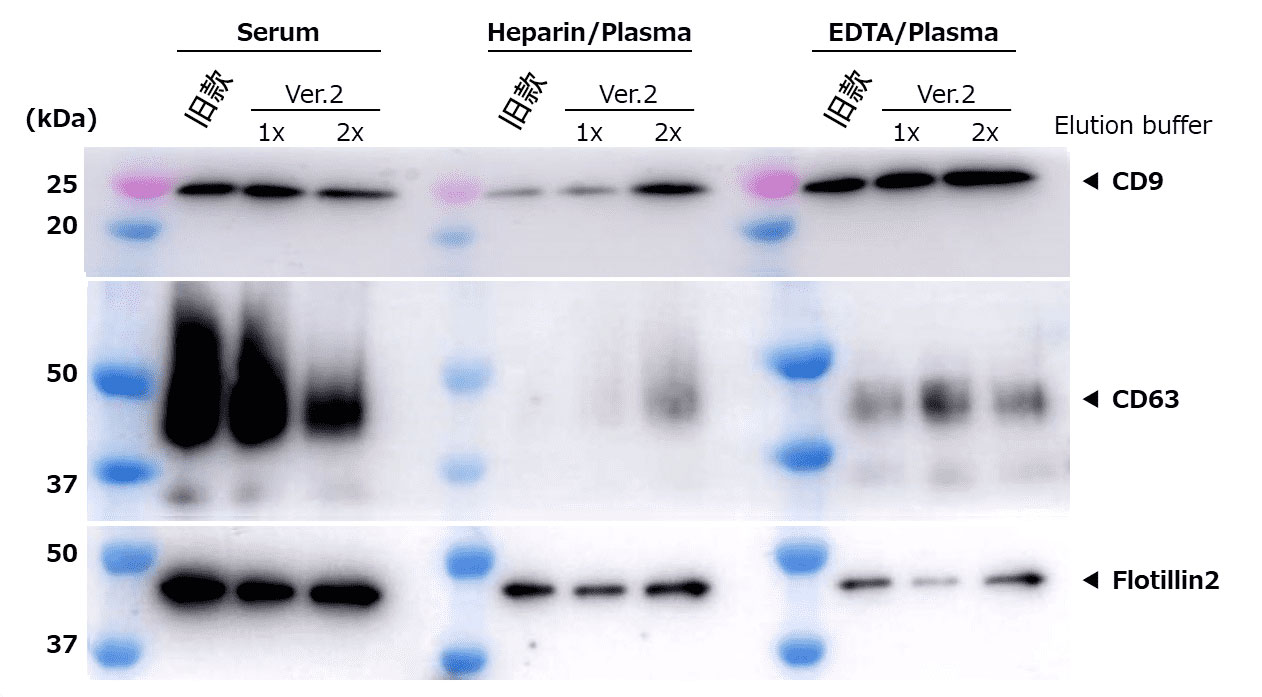
检测抗体:
抗CD9,大鼠单克隆抗体(77B)(产品编号: 019-28173)
抗CD63,单克隆抗体(3-13)(产品编号:012-27063)
抗Flotillin2,单克隆抗体(BD Biosciences)
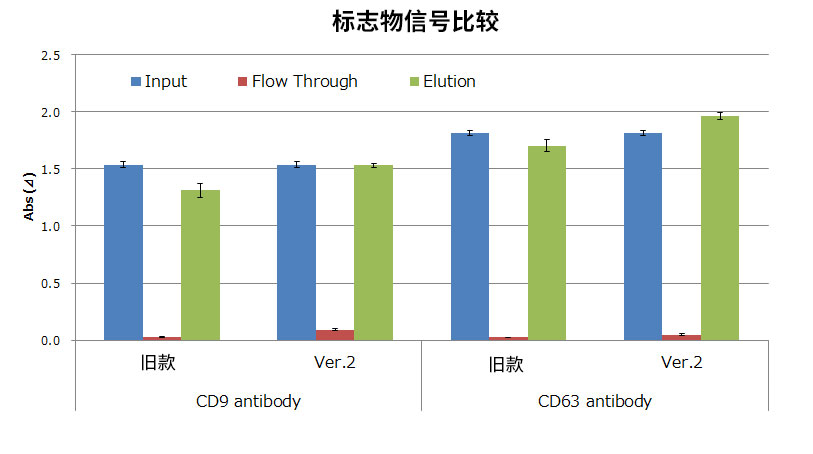
2. 外泌体回收率比较(间充质干细胞(MSC)培养上清)
使用MagCapture™外泌体提取试剂盒Ver.2(产品编号:290-84103)和旧款试剂盒从MSC培养上清中提取纯化外泌体(EV)。对获得的外泌体,
①使用PS Capture™外泌体ELISA试剂盒比较EV标志物
②通过Western blot比较EV标志物
③通过NTA进行粒子数测定
结果显示,旧款试剂盒相比Ver.2试剂盒回收效率更高。
①使用PS Capture™外泌体ELISA试剂盒比较EV标志物
②通过Western blot比较EV标志物
3. 纯化外泌体的细胞毒性试验
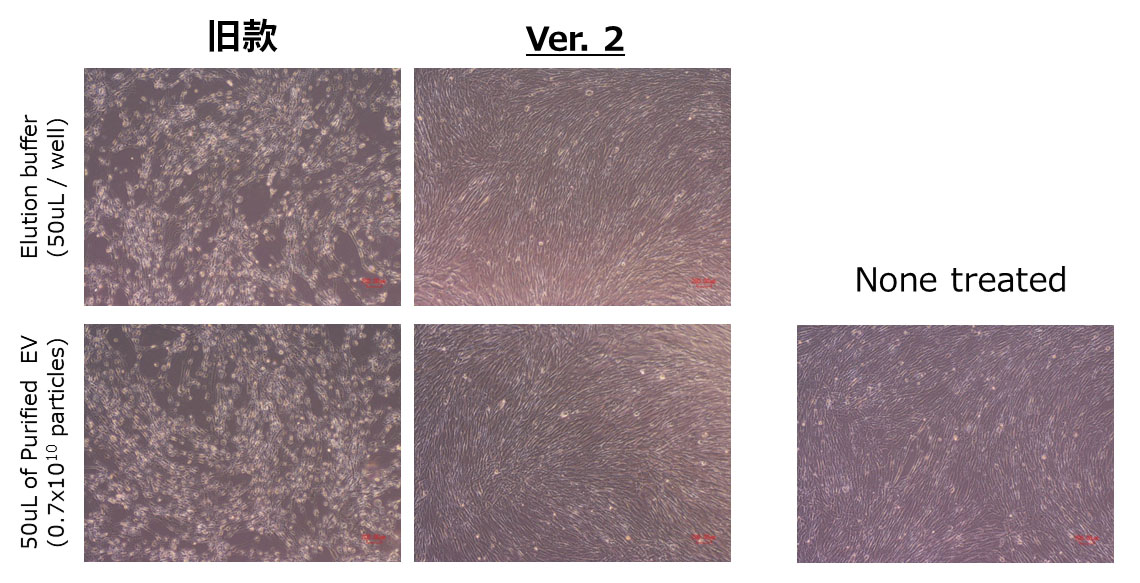
分别使用旧款试剂盒和Ver.2试剂盒从COLO201细胞培养上清中分离和纯化EV,再将等量的洗脱样品和对照洗脱缓冲液添加至提前接种的人正常成纤维细胞中,48 h后检测细胞形态变化。
结果显示,旧款试剂盒在添加Elution buffer和纯化外泌体48 h后,出现了细胞死亡现象,而使用Ver.2试剂盒时未观察到显著的细胞死亡。Ver.2试剂盒改善了旧款试剂盒存在的细胞毒性问题,因此无需更换Elution buffer即可用于In Vitro及In Vivo给药实验。
※ 若Elution buffer的EDTA出现问题时,需要更换缓冲液。
点击此处查看相关视频:MagCapture™ 外泌体提取试剂盒 PS Ver.2
相关资料
PS亲和法
通过使用T细胞免疫球蛋白结构域和粘蛋白域包含蛋白4(Tim4)分离高度纯化的外泌体。Tim4是在巨噬细胞上表达的I型跨膜蛋白,其强烈结合磷酯酰丝氨酸,不仅显示在凋亡细胞上,而且显示在外泌体和微泡。使用 Tim4蛋白,其特异性结合显示在外泌体表面上的磷酯酰丝氨酸。因为结合是 Ca2+依赖性的,完整的外泌体可以通过添加 Ca2+螯合剂容易地从 Tim4释放。值得注意的是,利用 PS 亲和法提取的外泌体纯度之高可以用过质谱显示的。还用于从细胞条件培养基沉淀中分离大外泌体和通过 ELISA、流式细胞术对外泌体的灵敏定量。这些结果表明通过 Tim4蛋白纯化的有用性表征 Evs 的真正功能。
(Wataru Nakai, Takeshi Yoshida, Diego Diez etl.A novel affinity-based method for the isolation of highly purified extracellular vesicles[J]Nature, Scientific Reports 6, Article number: 33935 (2016). doi:10.1038/srep33935)
|
◆操作流程
样品制备流程(步骤1)
![0814653747671398.jpg protocol[3]-cn.jpg](/upfiles/images/201606/0814653747671398.jpg)
外泌体捕获固定流程(步骤2)
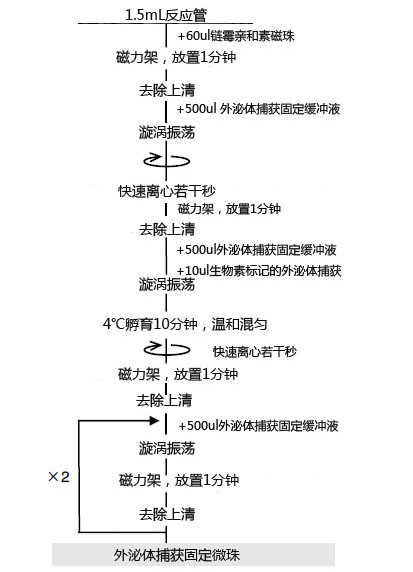
亲和提取流程(步骤3—5)

外泌体提取血浆样品前处理步骤
使用 TBS 缓冲液进行缓冲液交换
1、向 VIVASPIN 20(100K)中添加 19 mL TBS 缓冲液。
2、将1mL 血浆添加到(步骤1)的 VIVASPIN 20(100K)中并混合。
3、离心(步骤2)中的 VIVASPIN 20(100K)。(离心条件参考使用说明书)
4、当上层液体下降时,添加 10 mL TBS 缓冲液到(步骤3)的 VIVASPIN 20(100K)中。
5、离心。
6、当上层液体下降时,添加 10 mL TBS 缓冲液到(步骤5)的 VIVASPIN 20(100K)中。
7、离心。
8、当上层液体下降时,添加 11 mL TBS 缓冲液到(步骤7)的 VIVASPIN 20(100K)中。
9、离心 VIVASPIN 20(100K),直到样品体积变为1mL。
该方案共计使用 50 mL 的 TBS 缓冲液。
◆友情链接
延伸阅读:Thermo Fisher发布——六种血清外泌体分离方法的蛋白质组学比较研究 文章
常见问题
◆试剂盒的规格、性能
Q1-1:本提取方法的原理是什么?
A1-1:本提取方法利用了Tim4蛋白对存在于外泌体为代表的的细胞外囊泡(Extracellular Vesicles : EVs)膜表面的磷脂酰丝氨酸(以下称 PS),
以金属离子依赖性的方式进行结合以提取外泌体等的细胞外囊泡。是无需使用抗体的亲和提取法。
Q1-2:用此款试剂盒可提取什么样的细胞外囊泡呢?
A1-2:可提取 PS 暴露于脂质膜表面的外泌体和微囊泡。
Q1-3:外泌体和微泡的区别是?
A1-3:外泌体和微囊泡的区别在于其产生的方式不同。从晚期胞内体分泌的细胞外囊泡称为外泌体,从细胞膜直接出芽产生的细胞外囊泡称为微
囊泡。二者的大小也有所不同,外泌体的粒子直径约 40~100 nm,微囊泡的粒子直径约 100~1,000 nm,但有报道发现也存在小直径的
微囊泡,所以无法从粒子大小来明确区分二者。
Q1-4:外泌体和微泡能可以分别纯化吗?
A1-4:如上面所述,无法明确区分二者的大小,所以无法将二者完全分开。推荐使用下列简便的提取方法以便获得各主要的组分:提取外泌体等
粒子直径小的细胞外囊泡(Small EVs)时,请选用 10,000×g 离心后的上清样品;提取含微囊泡在内的粒子直径大的细胞外囊泡
(Large EVs)时,首先要回收 1,200×g 离心的上清,然后将其 10,000×g 离心分离获得的沉淀用TBS悬浮后作为样品使用。
A1-4:如果同时提取上述两种细胞外囊泡,请使用 1,200×g 离心分离的上清作为样品。
A1-4:详细的样品预处理条件请参考产品的使用说明书。
Q1-5:会回收到外泌体、微囊泡以外的东西吗?
A1-5:会回收到带包膜的病毒,因为包膜病毒的膜表面也会暴露 PS 。利用这个特点也可以将本试剂盒应用于包膜病毒的提取实验。若想进一步
分离出细胞外囊泡与包膜病毒,使用本试剂盒提取后,必须使用病毒特异性抗体进行亲和提取。本方法也适用于对包膜上有着 CD63 等外
泌体标记的包膜病毒提取。
Q1-6:外壳型病毒也能回收吗?所有的外泌体都会暴露磷脂酰丝氨酸(PS)吗?
A1-6:在以下论文中,报告了使用本方法的病毒纯化。
A1-5:“Vesicle-Cloaked Virus Clusters Are Optimal Units for Inter-organismal Viral Transmission”, M. Santiana, et al.,
Cell Host & Microbe, 24, 208-220 (2018)
Q1-7:所有的外泌体都会暴露磷脂酰丝氨酸(PS)吗?
A1-7:虽然没有证据表明所有的外泌体都暴露了 PS,但是在 FUJIFILM Wako 的操作实例(参考:纯化实绩和检测实绩)中,尚未发现无法检测
的样品。
A1-7:在以下的论文中报告了使用冷冻电子显微镜以及免疫金胶体颗粒的活性化血小板来源细胞外囊泡的表型分析。
A1-7:据该论文报道,约 75% 的活性化血小板来源细胞外囊泡都会在其表面暴露 PS。
A1-:“Extracellular vesicles from activated platelets : a semiquantitative cryo-electron microscopy and immuno-gold labeling study”,
B. Alain R, et al., Platelets, 28(3),263-271( 2017)
Q1-8:本试剂盒可以从哪些样品中提取外泌体?一次能回收多少外泌体?
A1-8:FUJIFILM Wako 的操作实例中,有使用过细胞培养上清、血清、肝素-血浆、EDTA 血浆、尿液、粪便等作为提取样品。另外,也有用户使
用本试剂盒,从脑脊髓液和唾液中提取外泌体。
Q1-9:一次能回收多少外泌体?
A1-9:实验样品的种类和体积不同,回收到的外泌体量也大不相同。在 FUJIFILM Wako 的操作实例中,一次提取操作可获得约30 μg/mL的蛋白
(BCA 法检测),粒子数1~2×1010(NanoSight LM10 检测)(经莫能菌素钠(产品编号:ALX-380-026-G001)刺激外泌体分泌的
K562 培养上清5mL 浓缩为1mL 后,对其进行纯化)。从1mL 正常人混合血清提取一次,可回收约 34 μg/mL 蛋白( BCA 法检测),
粒子数约5×109/mL(NanoSight LM10 检测)。本试剂盒最终可获得 100 μL 的洗脱液。
Q1-10:能从小鼠血清中分离外泌体吗?
A1-10:可以。在 Western blotting 中检测 CD9 的实验案例如下:
A1-10:标准样品:小鼠血清 500 μL
A1-10:分离的外泌体总量:100 μL(蛋白浓度:17 ng/μL,BCA)
A1-10:各条带的分布量:10 μL
A1-10:一抗:BioLegend Purified anti-mouse CD9 Antibody(产品编号:124802)
A1-10:二抗:抗大鼠 IgG,过氧化物酶标记
◆与传统法比较
Q2-1:与超离相比的优势是什么?
A2-1:与超离法相比,本试剂盒能更简便地回收高纯度外泌体,且重复性好,回收率高。还能提:取超速离心法难以沉淀的外泌体。
A2-1:所提取的外泌体纯度高,相当于超离法和密度梯度法相结合时得到的外泌体组分。
Q2-2:与抗体亲和法相比,PS亲和法的优势是什么?
A2-2:抗体亲和法使用外泌体表面抗原相对应的抗体,必须用变性剂洗脱在酸性条件下分离提取外泌体。而本试剂盒是在中性环境下用螯合剂来
洗脱的,能提取近乎完整的外泌体。由于洗脱过程无需使用变性剂,磁珠非特异性吸附蛋白杂质少,能回收更高纯度的外泌体,且外泌体
回收率更高。
A2-1:标记蛋白的表达量随外泌体来源细胞的不同而有所差异,传统抗体亲和法只能特异性识别一种外泌体表面标记蛋白,与之相比,本试剂盒
可特异性识别膜脂质成分,回收范围更广。另外,有实例证明识别表面标记蛋白的抗体不能识别不同动物种抗原,而本试剂盒能运用于大
范围的动物物种中(人,小鼠,牛等都有实例)。
Q2-3:与聚合物沉淀法相比,其优点是什么?
A2-3:与聚合物沉淀法相比,回收效率更高,而且可提取更高纯度的外泌体。
◆试剂盒的操作方法、组成
Q3-1:操作本试剂盒耗时多久?
A3-1:样品预处理约1h,试剂盒所有的步骤总计需要 3.5 h 。具体操作步骤包括:
①外泌体捕获磁珠的固定需要 15 min;
②与样品反应需要3h;
③外泌体的清洗和洗脱需要约 35 min。可以将于样品反应的时间缩短至1h,但需要进行预实验确认对实验结果没有影响。
Q3-2:使用本试剂盒时,有哪些需要特别慎重的操作吗?
A3-2:Exosome Capture 固定化磁珠与样品反应后的清洗步骤中最后需要去除洗净液。完全去除后再进行提取。
A2-1:提取时在提取液中加入磁珠后,确保磁珠不发生凝集并处于悬浮状态。
Q3-3:提取液的组成有哪些?
A3-3:是含有1mM 的螯合剂、盐、防腐剂的 Tris 基础溶液。若以上成分阻碍后续分析,请使用超速离心膜(Sartorius公司 VivaSpin500,
使用 100K 分子量截留,产品编号:VS0141)并替换合适的 Buffer 。
Q3-4:外泌体捕获固定化磁珠可以循环利用吗?
A3-4:可以。为了能够重复回收样品中残留的外泌体,使用过的磁珠最多可再回收利用4次。试剂盒内缓冲液量充足,如果是从同一样品中重复
提取或实验对污染没要求,10 次用试剂盒最多可进行 50 次反应。如果样品体积大于1mL 或样品已浓缩,建议可对磁珠进行回收循环利
用。详情参考使用说明书。
Q3-5:外泌体捕获固定化磁珠能保存吗?
A3-5:可以。重复利用外泌体洗脱后的外泌体捕获固定化磁珠时,请使用试剂盒配套的 Washing buffer 或自行配制的 TBS 冷藏保存
(FUJIFILM Wako实例:2年)
Q3-6:实验操作中有可以留到第二天的步骤吗?
A3-6:Exosome Capture 固定化磁珠与样品的反应步骤(反应时间3h)可以反应过夜反应。
◆样品用量
Q4-1:样品纯化所需的最低量是多少?
A4-1:为了稳定地让磁珠和样品混合,使用旋转混合仪反应时请准备 500 μ L以上的样品,使用试管混合器时请准备 100 μL 以上的样品。
A2-1:若使用的样品量比上述的少时,请添加 TBS 至高于最低上样量,再与外泌体捕获固定化磁珠反应。另外,用于补平的TBS推荐添加
EV-Save™。
Q4-2:可以从大量的样品中回收吗?
A4-2:浓缩后可再回收。如果是培养上清的情况下,最多可以从 50 mL 的样品中提取外泌体。请将离心分离预处理后的 50 mL 细胞培养上清超
虑浓缩至1mL(推荐超滤管:Sartorius Vivaspin20,截留分子量 100 K、产品编号:VS2041)。可兼容无血清培养基及含10% FBS的
培养基。由于血清样品无法浓缩,最多只能用1mL 的样品。详情参考产品说明书。
A2-1:另外,通过超滤浓缩外泌体会吸附在容器或滤膜上而减少。在进行超滤时,请添加 EV-Save™ 细胞外囊泡吸附抑制剂(产品编号:
058-09261),防止吸附损失。但是由于 EV-Save™ 本产品含有聚合物,不建议使用于蛋白组学分析的样品。
Q4-3:超滤浓缩中推荐使用截留分子量 100 K,可以使用 10 K 吗?
A4-3:FUJIFILM Wako 经过比较 100 K,300 K,1000 K 的超滤管,从浓缩时间和浓缩的外泌体量的结果来看,推荐使用 100 K。虽然 10 K
和 30 K 也可以使用,但是浓缩时间可能会变长。另外若培养基含有可被浓缩的白蛋白,可能会降低回收效率。
◆外泌体提取后的分析
Q5-1:外泌体中含有什么?
A5-1:含有蛋白质、脂质、核酸(DNA、microRNA、mRNA)等。
Q5-2:提取后的细胞外囊泡可以用什么方法检测?
A5-2:因为能得到完整的细胞外囊泡,可以使用所有的分析方法。
A2-1(例)蛋白质分析:蛋白质电泳、免疫印迹、质谱分析、流式细胞术、ELISA 等核酸分析如:定量 PCR、微阵列(生物芯片)、
新一代测序等粒子分析:电镜分析,纳米位点分析(NTA)等
A2-1:功能分析:体内外的用药实验等
Q5-3:提取后的细胞外囊泡(EVs)能直接用于细胞的摄取实验中吗?
A5-3:由于试剂盒配套的洗脱缓冲液中的防腐剂有细胞毒性,请另行制备含 2 mmol/L EDTA 的 PBS 缓冲液作为洗脱缓冲液。获得的纯化细胞外
囊泡样品用针头式过滤器(Millipore Ultrafree-MC,GV 0.22 μm sterile,产品编号:UFC30GV0S)进行除菌,用于细胞摄取实验等。
甚至为防止吸附而添加了EV-Save™ 的细胞外囊泡样品,也可直接用于实验。
Q5-4:电镜分析需要的外泌体量是多少?
A5-4:FUJIFILM Wako 在电镜分析中使用2~4×1010 particles/mL(用 NanoSight LM10 检测)的样品。
Q5-5:微阵列分析需要的外泌体量是多少?
A5-5:FUJIFILM Wako 从下述的粒子数(用 NanoSight LM10 检测)的外泌体中提取 RNA,进行微阵列分析。
A5-5:COLO201: 4.6×1010 particles
A5-5:TIG3: 1.7×1010 particles
A5-5:iPS: 1.9×109 particles
Q5-6:蛋白组学分析需要的外泌体量是多少?
A5-6:外泌体提取、纯化试剂页面所介绍的蛋白组学分析(W. Nakai, et al., Sci. Rep., 6, 33935, 2016)中,使用了约 1 μg 的纯化外泌体。(该
外泌体来源于约 1.5 mL 的 K562 细胞培养上清样品。该样品以莫能菌素(产品编号:ALX-380-026-G001)促进外泌体的分泌,使外泌体
的量增多。)
Q5-7:如何保存纯化的细胞外囊泡?
A5-7:添加 EV-Save™ 细胞外囊泡封闭试剂(产品编号:058-09261),冷藏或冷冻保存。长期保存请置于-80℃。
A2-1:EV-Save™ 有冷冻保护作用,可使冻存的纯化细胞外囊泡不受损伤。但是由于本产品含有聚合物,不建议用于蛋白组学分析样品。
◆关于外泌体标记
Q6-1:如何确认用本试剂盒纯化的外泌体?
A6-1:根据表面抗原的抗体(WB)、电子显微镜、密度梯度离心、纳米粒度测量(如 NanoSight LM10)等来验证。
◆相关产品
Q7-1:可以提供可用于 Western blotting 的外泌体标记检测抗体吗?
A7-1:FUJIFILM Wako提供有应用实例的以下抗体:
抗原 | 反应 | 抗体 | 制造商 | 应用 |
CD63 | 人 | 抗CD63小鼠单克隆抗体(3-13) | WB、ELISA、FCM、IP | |
CD81 | 人、牛 | 抗CD81小鼠单克隆抗体(17B1) | WB、ELISA、FCM、IP | |
CD9 | 人、牛 | 抗CD9小鼠单克隆抗体(1K) | WB、ELISA、FCM、IP | |
TSG101 | 人 | 抗Tsg101小鼠单克隆抗体(4A10) | Novus,产品编号:NB200-112 | WB |
Alix | 人 | 抗Alix小鼠单克隆抗体(3A9) | Novus,产品编号:NB100-65678 | WB |
Q7-2:有可以从分离囊泡里提纯 RNA 的试剂盒吗?
A7-2:有。可使用 microRNA Extractor SP Kit(产品编号:295-71701)比 AGPC 法更能高效提纯 RNA。
Q7-3:FUJIFILM Wako 也可以提供磁力架吗?
A7-3:有的。FUJIFILM Wako 也提供磁珠捕获用磁力架(产品编号:290-35591)。
◆实验条件
Q8-1:莫能菌素钠的使用条件是什么?
A8-1:培养 K562 细胞时使用的莫能菌素钠的最终浓度为 10 μmol/L。用乙醇溶解莫能菌素钠(产品编号:ALX-380-026-G001),配制成
10 mmol/L,按 1/1000 体积添加到培养基中使用。
A8-1:参考文献:
A8-:“Exosome Release Is Regulated by a Calcium-dependent Mechanism in K562 Cells. J Biol Chem.,
A8-1:2003 May 30, 278( 22), 20083-90.”
Q8-2:阳性对照样品应该怎么准备?
A8-2:培养 HEK293 等任意的对照细胞,准备所需要的细胞培养上清量,用 FUJIFILM Wako 的试剂盒纯化外泌体。纯化的外泌体可以用
Western blotting 或 ELISA 分析以鉴定 CD9、CD63、CD81 等外泌体标记蛋白的表达情况。
A8-1:另外,关于培养条件举一个 FUJIFILM Wako 实验室里的案例,在血清培养基中培养一天后,更换为无血清培养基和含去外泌体的
FBS 的培养基,培养3天左右后收集细胞培养上清。
Q8-3:BCA Assay 的操作步骤是什么?
A8-3:请按照以下的操作,制备标准品的标准曲线。由于本试剂盒中分离纯化的外泌体的蛋白浓度非常低,建议无需稀释直接进行检测。
A8-1:① 把 250、125、62.5、31.25、15.625 μg/mL 的 BSA 标准溶液、空白标准品分别以 25 μL/孔添加至 96 孔板孔中;
A8-1:② 把外泌体溶液和洗脱缓冲液(空白)以 25 μL/孔添加至 96 孔板中;
A8-1:③ 添加 200 μL Protein Assay BCA Kit(产品编号:297-73101)配套的试剂A和试剂B的混合液(A:B=50:1)至上述的①,②中;
A8-1:④ 60℃ 孵育 30 min;
A8-1:⑤ 室温冷却孔板;
A8-1:⑥ 在 560 nm 下检测吸光度。
◆疑难
Q9-1:实验不熟练的人员应作何准备?
A9-1:参照Q36准备阳性对照。另外,也有培养基中的细胞外囊泡较少的可能性,可以适当扩大培养量。
Q9-2:与其他方法回收的外泌体样品相比,本试剂盒纯化的外泌体样品的总蛋白量偏少,这是什么原因呢?
A9-2:由于其他方法回收的外泌体样品中,存在许多杂质,所以总蛋白量会变多。另一方面,虽然本试剂盒纯化外泌体样品的总蛋白量少,但是样
品的纯度高,所获得的外泌体量不比其他方法少。
参考文献
1. Tkach, M. et al.: Cell., 164(6), 1226-1232 (2016).
Communication by Extracellular Vesicles: Where We Are and Where We Need to Go
2. Raimondo, F. et al.: Proteomics., 11(4), 709-20 (2011).
3. Trajkovic,K. et al.: Science., 319(5867), 1244-7 (2008).
Ceramide triggers budding of exosome vesicles into multivesicular endosomes
4. Mianishi, M. et al.: Nature., 450(7168) , 435-9 (2007).
Identication of Tim4 as a phosphatidylserine receptor
5. Nakai, W. et al.: Sci.Rep., 6 (33935) (2016).
A novl affinity-based method for the isolation of highly purified extracellular vesicles
6. Ren, Y. et al.: Biosens Bioelectron., 199, 113870 (2021).
7. Lim,K. et al.: J Extracell Vesicles., 10(14), e12170 (2021).
8. Leilei, Shi.: University of Cincinnati, (2021).
A Rapid and Label-free Method for Isolation and Characterization of Exosomes
9. Mwase, C. et al.: Cells., 11(2), 256 (2022).
10. Petrouskova, P. et al: Life (Basel)., 12(4), 524 (2022).
Non-Exosomal and Exosome-Derived miRNAs as Promising Biomarkers in Canine Mammary Cancer
11. Bertkova, A. et al.: Biomed Pharmacother. 151, 113093 (2022).
Exosomes from prostate cancer cell lines: Isolation optimisation and characterisation
12. Inagaki, M. et al.: Chem. Pharm. Bull., 70, 324-329 (2022).
13. Zhang. M. et al.: Environ Sci Technol., 56(12), 8475-8484 (2022).
14. Kaneko, K. et al.: IEEE (2022).
Detection of nanoparticles in a minute sample using the vibration induced flow
15. Shi, Y. et al.: Front Biosci (Landmark Ed)., 27(7) , 205 (2022).
Exosomes in Liquid Biopsy: A Nanotool for Postradiotherapy Cancer Monitoring
16. Ghosh, S. et al.: Nature, 607, 345-350 (2022).
Enteric viruses replicate in salivary glands and infect through saliva
17. Kahrizi, M. et al.: Nanomed Res J., 7(2), 189-194 (2022).
18. Shirai, K. et al.: PLoS One., 17(7) (2022).
19. Mahmoudi, H. et al.: Nanomed Res J., 7(3), 294-300 (2022).
20. Peng, Y. et al.: BMC Immunol., 23(1), 37 (2022).
Blockade of exosome generation by GW4869 inhibits the education of M2 macrophages in prostate cancer
21. Yamashita, T. et al.: Ophthalmology Science, (2022).
Cellular Interplay through Extracellular Vesicle miR-184 Alleviates Corneal Endothelium Degeneration
22. Watanabe, Y. et al.: Scientific Reports, 12(13344) (2022).
23. Zhang, Y. et al.: Mol Biol Rep., 49(10), 9275-9281 (2022).
Exosomal mir-625-3p derived from hypoxic lung cancer cells facilitates metastasis by targeting SCAI
24. Watanabe, S. et al.: PNAS Nexus, 1(4) (2022).
25. Lyu, X. et al.: Pharm Res., 1-9 (2022).
Preventing SARS-CoV-2 Infection Using Anti-spike Nanobody-IFN-β Conjugated Exosomes
26. Sajidah, E. et al.: J Extracell. Vesicles, 11(11), (2022).
27. Muraoka, S. et al.: ACS Omega, 7(45), 41472-41479 (2022).
28. Takizawa, K. et al.: iScience, 25(11), 105416 (2022).
Urinary extracellular vesicles signature for diagnosis of kidney disease
29. Shibata, C. et al.: Biochem. Biophys. Res. Commun., 637, 314-321 (2022).
30. Wang, Y. et al.: Physiol. Int. (2022).
31. Saigusa, D. et al.: Medical Mass Spectrometry, 6(2), 126-137 (2022).
Lipidomic and metabolic profiling of plasma and plasma-derived extracellular vesicles by UHPLC-MS/MS
32. Kawasaki, T. et al.: Inflammation and Regeneration, 42(53) (2022).
33. Suzuki, K. et al.: Pharm. Res. (2022).
34. Giancaterino, S. et al.: Biotechnol. Adv., 63 (2023).
35. Soupir, A. et al.: Int.J. Mol. Sci., 24(3) (2023).
36. Cano, A. et al.: Pharmaceutics, 15(1), 298 (2023).
Exosomes-Based Nanomedicine for Neurodegenerative Diseases: Current Insights and Future Challenges
37. Misawa, T. et al.: Int. J. Mol. Sci., 24, 2421 (2023).
Identification of Novel Senescent Markers in Small Extracellular Vesicles
38. Zhao, Y. et al.: Heliyon. 9(2) (2023).
39. Ishibashi, A. et al.: Nutrients, 15(6), 1472 (2023).
Molecular Mechanisms for the Carnosine-Induced Activation of Muscle–Brain Interaction
40. Takeda, A. et al.: Analytical Biochemistry, 115130 (2023).
41. Sonohara F. et al.: Anticancer Research, 40(4) (2020).
42. Farhana Y. et al.: Scientific Reports, 13(4987) (2023).
43. Andari S. et al.: Biomedicines, 11(4), 1053 (2023).
Plant-Derived Exosome-like Nanoparticles for Biomedical Applications and Regenerative Therapy
44. Peter B. Gahan. et al.: Cancer Screening and Prevention, 2(1) (2023).
45. Kaneko K, et al.: ChemRxiv Home (2023).
46. Jie H. , et al.: Anal. Chem(2023).
47. Klara H , et al.: Cell Communication and Signaling, 21(120) (2023).
48. Bruno Moises de Matos Matos, et al.: World J Stem Cell, 15(5) (2023).
Human pluripotent stem cell-derived extracellular vesicles: From now to the future
49. Bardia M, et al.: Nanomed Res J, 8(2) (2023).
Mesenchymal stem cell derived exosome promotes the viability of ameloblast-like cells
50. Smrity S. et al.: Biosensors, 13(8) (2023).
Biogenesis, Isolation, and Detection of Exosomes and Their Potential in Therapeutics and Diagnostics
51. Ling K. et al.: Ecotoxicology and Environmental Safety, 262 (2023).
52. Taku K. et al.: CANCER GENOMICS & PROTEOMICS, 20(456) (2023).
53. Haruka K. et al.: MolecularMedicineReports, 28(4) (2023).
Serum levels of vault RNA significantly varied in patients with haematological malignancies
54. Maki Y. et al.: Indones Biomed J., 15(4) (2023).
Electric Field Stimulation of Stem Cell Culture Media Increases Oxygen Radical Uptake Capacity
55. Yasufumi T. et al.: Analytical Chemistry, 95(34) (2023).
https://pubs.acs.org/doi/abs/10.1021/acs.analchem.3c01010
56. Eisuke K. et al.: Analytical Chemistry, 95(38) (2023).
57. XINCHAN J. et al.: EXPERIMENTAL AND THERAPEUTIC MEDICINE, 26(526) (2023).
58. Wakako W.: 静岡理工科大学紀要Vol.31 (2023).
エクソソーム中の糖化ストレス誘導性 miRNA の網羅的解析
59. Takuya Y. et al.: Biological and Pharmaceutical Bulletin, 46(11) (2023).
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 294-84101 | MagCapture™ Exosome Isolation Kit PS Ver.2 MagCapture™ 外泌体提取试剂盒 PS Ver.2 |
2次用 | 基因研究用 | |
| 290-84103 | MagCapture™ Exosome Isolation Kit PS Ver.2 MagCapture™ 外泌体提取试剂盒 PS Ver.2 |
10次用 | 基因研究用 |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 290-80301 | PS Capture(TM) Exosome Isolation Resin Kit PS Capture™外泌体提取树脂试剂盒 |
1 Kit | 基因研究用 | - |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 297-79201 | PS Capture(TM) Exosome ELISA Kit (Anti Mouse IgG POD) PS Capture™外泌体ELISA试剂盒(抗小鼠IgG POD) |
96 tests | 基因研究用 | - |
| 298-80601 | PS Capture(TM) Exosome ELISA Kit (Streptavidin HRP) PS Capture™外泌体ELISA Kit (链霉亲和素HRP) |
96 tests | 基因研究用 | - |
| 296-83701 | CD9-Capture Human Exosome ELISA Kit (Streptavidin HRP) CD9-Capture 人外泌体ELISA试剂盒(链霉亲和素HRP) |
96 tests | 基因研究用 | - |
| 290-83601 | CD63-Capture Human Exosome ELISA Kit (Streptavidin HRP) CD63-Capture 人外泌体ELISA试剂盒(链霉亲和素HRP) |
96 tests | 基因研究用 | - |
| 292-83801 | CD81-Capture Human Exosome ELISA Kit (Streptavidin HRP) CD81-Capture 人外泌体ELISA试剂盒(链霉亲和素HRP) |
96 tests | 基因研究用 | - |
| 297-79701 | PS Capture(TM) Exosome Flow Cytometry Kit PS Capture™外泌体流式试剂盒 |
96 tests | 基因研究用 | - |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 012-27063 | Anti CD63, Monoclonal Antibody (3-13) 抗CD63单抗(3-13) |
100 μL | 免疫化学用 | - |
| 014-27643 | Anti CD63, Monoclonal Antibody (3-13), Fluorescein Conjugated 抗CD63,单克隆抗体(3-13),荧光素结合 |
100 tests | 免疫化学用 | - |
| 019-27713 | Anti CD63, Monoclonal Antibody (3-13), Biotin Conjugated 抗CD63单克隆抗体(3-13),生物素偶联 |
100 μL | 免疫化学用 | - |
| 011-27751 | Anti CD63, Monoclonal Antibody (3-13), Red Fluorochrome(635) Conjugated 抗CD63单克隆抗体(3-13),红色荧光染料(635)偶联 |
25 tests | 免疫化学用 | - |
| 017-27753 | Anti CD63, Monoclonal Antibody (3-13), Red Fluorochrome(635) Conjugated 抗CD63单克隆抗体(3-13),红色荧光染料(635)偶联 |
100 tests | 免疫化学用 | - |
| 014-27763 | Anti CD9, Monoclonal Antibody (1K) 抗CD9单克隆抗体(1K) |
100 μL | 免疫化学用 | - |
| 011-27773 | Anti CD81, Monoclonal Antibody (17B1) 抗CD81单克隆抗体(17B1) |
100 μL | 免疫化学用 | - |
| 013-27951 | Anti CD9, Rat Monoclonal Antibody (30B) , Biotin Conjugated 抗CD9,大鼠单克隆抗体(30B),生物素标记 |
20 μL | 免疫化学用 | - |
| 019-27953 | Anti CD9, Rat Monoclonal Antibody (30B) , Biotin Conjugated 抗CD9,大鼠单克隆抗体(30B),生物素标记 |
100 μL | 免疫化学用 | - |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 058-09261 | EV-Save™ Extracellular Vesicle Blocking Reagent EV-Save™ 细胞外囊泡保存稳定剂(超滤用) |
1 mL | 基因研究用 | - |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 081-10261 | Human TIM4/Human Fc Chimera, recombinant 人Tim4/人Fc嵌合体,重组 |
100 μg | 基因研究用 | - |
| 137-18511 | Mouse TIM4/Human Fc Chimera, recombinant 鼠标TIM4/人Fc嵌合体,重组 |
100 μg | 基因研究用 | - |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 299-36421 | MAGNET STAND MagCapture系列磁珠捕获用磁力架 |
1个 | - | - |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |