ScreenFect A+
DNA & siRNA 转染试剂
通过点击化学开发的新型脂质体!!
ScreenFect ™A plus(也称作ScreenFect ™A+)是通过点击化学(Click Chemistry)筛选※1出的新型阳离子脂质体组成的转染试剂,适用于各种真核生物来源的细胞,也可直接添加至含有抗生素或者血清的培养基中。
使用 ScreenFect ™A plus转染试剂可将DNA和siRNA导入通用实验细胞系(HeLa、HepG2、MDCK等)、干细胞(小鼠ES细胞等)、血细胞(巨噬细胞、THP-1、RAW264.7等)、小胶质细胞、原代细胞(原代培养)和昆虫细胞中。其细胞毒性低,因此转染后无需更换培养基。另外,试剂成分中不含有任何有毒有害物质。
※1 Biomaterials. 2012 Nov; 33(32):8160-6. 2012
特点
● DNA和ScreenFect ™A plus试剂混合比例可选范围更广
● 使用一步法缩短分析时间至1天
● 可高效转染难以导入的细胞
● 成本低
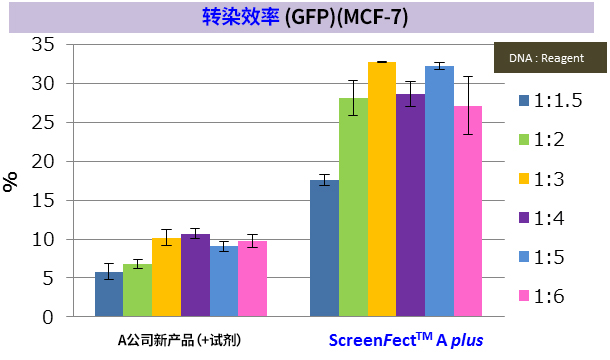
ScreenFect ™A plus 转染性能
 |
|
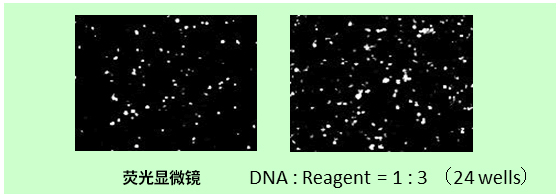
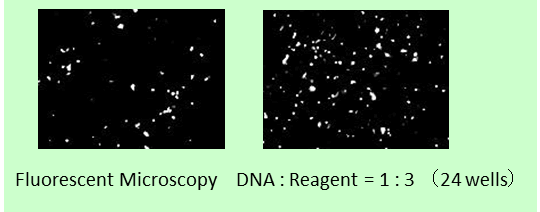
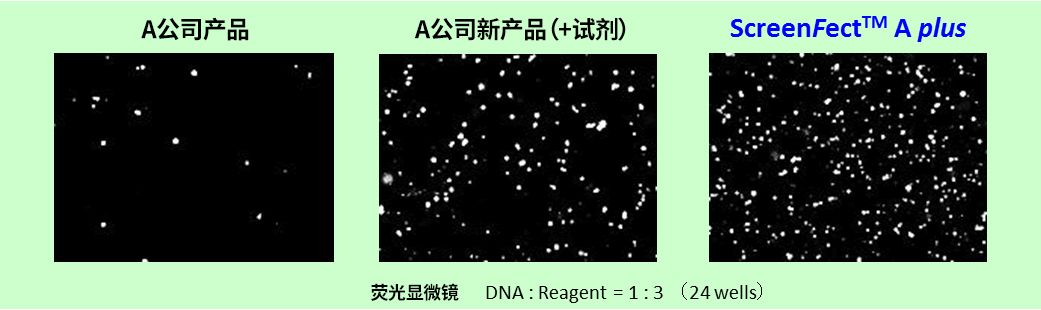
※ MCF-7:人乳腺癌来源细胞(上皮细胞样形态)(贴壁系)
※ 导入方法:A公司新产品 → 2步法,ScreenFect ™A plus → 1步法
改善难以导入的细胞的转染效率! |
|
|
※ MDCK:狗肾小管上皮细胞来源(贴壁系)
※ 导入方法:A公司新产品 → 2步法,ScreenFect ™A plus → 1步法
改善难以导入的细胞的转染效率! |
|
|
※ K562:人慢性髓性细胞白血病细胞来源(悬浮系)
※ 导入方法:A公司新产品 → 2步法,ScreenFect ™A plus → 1步法
改善难以导入的细胞的转染效率! |
◆应用数据
1. 向LNCaP细胞(贴壁系)中导入YFP融合基因的实验
进行向LNCaP细胞(贴壁系)中导入YFP融合基因的实验,在荧光显微镜下比较导入基因的表达效率。
使用ScreenFect ™A plus和增强剂SFA P-reagent,可以观察到与其他公司产品相同或更高的表达效率。
※ 数据刊登于BioWindow No.144 (2016年6月号)
LNCap (人前列腺癌) 中的性能比较
|
|
〔接种细胞数〕3×105 cells/well 〔质粒DNA量〕1 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 3 〔孔板〕24孔板 | 〔接种细胞数〕1.5×105 cells/well 〔质粒DNA量〕1 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 3 〔孔板〕24孔板 |
2. 向HeLa细胞(贴壁系)中导入EGFP_mRNA的实验
进行向HeLa细胞(贴壁系)中导入EGFP_mRNA的实验,在荧光显微镜下比较EGFP的表达效率。
使用ScreenFect ™A plus和增强剂SFA P试剂(产品编号:191-18331、197-18333),可以观察到与其他公司产品相同或更高的表达效率。
※ 数据刊登于BioWindow No.144 (2016年6月号)
HeLa细胞中的mRNA转染性能比较

〔接种细胞数〕0.7 x 105 cells/well
〔mRNA量〕0.1 µg/assay
〔转染试剂混合比例〕mRNA量 (µg) : ScreenFect ™ A plus 试剂(µL) = 1 : 4
〔检测时间〕转染后48 h
〔曝光时间〕2 s
3. 向hiPSC(201B7株)中导入GFP融合基因的实验
进行将hiPSC(201B7株) 通过反向转染(1-STEP)导入GFP融合基因的实验,在荧光显微镜以及流式细胞仪下比较导入基因的表达效率。
使用反向转染法转染hiPS细胞的效果优异,在StemSure® hPSC培养基Δ和mTeSR™ 1两个培养基中,ScreenFect ™A plus表现出与其他公司产品相同或更高的导入效率。
※ 数据刊登于BioWindow No.144 (2016年6月号)
hiPSC(201B7株)中的性能比较
1-step 使用StemSure® hPSC培养基Δ | |
|
|
ScreenFect™A plus的转染条件 〔细胞数〕5×105 cells/well 〔质粒DNA量〕4 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 0.5 〔孔板〕12孔板 〔备注〕SFA plus reagent以及pDNA使用了Opti-MEM® 进行稀释。 | 其他公司产品的转染条件 〔细胞数〕5×105 cells/well 〔质粒DNA量〕2 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 2 〔孔板〕12孔板 |
1-step 使用mTeSR™1培养基 | |
|
|
ScreenFect™A plus和其他公司产品的转染条件 〔细胞数〕5×105 cells/well 〔质粒DNA量〕1 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 2 〔孔板〕12孔板 〔备注〕SFA plus reagent以及pDNA使用了Opti-MEM® 进行稀释。 | |
4. 向HeLa细胞(贴壁系)中导入PIK3CB siRNA的实验
使用反向转染(1-STEP)法以及正向转染(2-STEP)法进行向HeLa细胞中导入PIK3CB siRNA的实验,通过实时定量PCR测量PIK3CB mRNA的表达水平。
在定量结果的基础上与其他公司产品比较敲降效率,结果显示ScreenFect ™A plus表现出与其他公司产品相同或更高的敲降效率。
※ 数据刊登于BioWindow No.149 (2017年3月号)
HeLa细胞中的性能比较
|
|
〔接种细胞数〕1×105 cells/well 〔siRNA〕5 pmol/assay 〔转染试剂混合比例〕ScreenFect ™A plus reagent = 0.5~1.5 µL 其他公司产品 = 1.5 μL 〔孔板〕24孔板 〔检测时间〕48 h后进行确认 | 〔接种细胞数〕0.5×105 cells/well 〔siRNA〕5 pmol/assay 〔转染试剂混合比例〕ScreenFect ™A plus reagent = 0.5~1.5 µL 其他公司产品 = 1.5 μL 〔孔板〕24孔板 〔检测时间〕48 h后进行确认 |
◆使用方法、拥有使用实绩的细胞
1-Step与2-Step 操作比较
产品 | ScreenFect™A plus | A公司新产品(+reagent) | A公司的新产品 |
各条件 | 1-Step | 2-Step | |
实验方案天数 | 2 Days | 3 Days | |
DNA量 | 少 | 多 | |
是否需要调整细胞数 | 可随时调整 | 取决于预培养条件 | |
是否需要胰蛋白酶处理 | 转染时 | 预培养时 | |
基于HTS细胞检测的可操作性 | +++++ | + | |
是否需要更换培养基 | 取决于细胞 | ||
ScreenFect ™A plus一步法概要
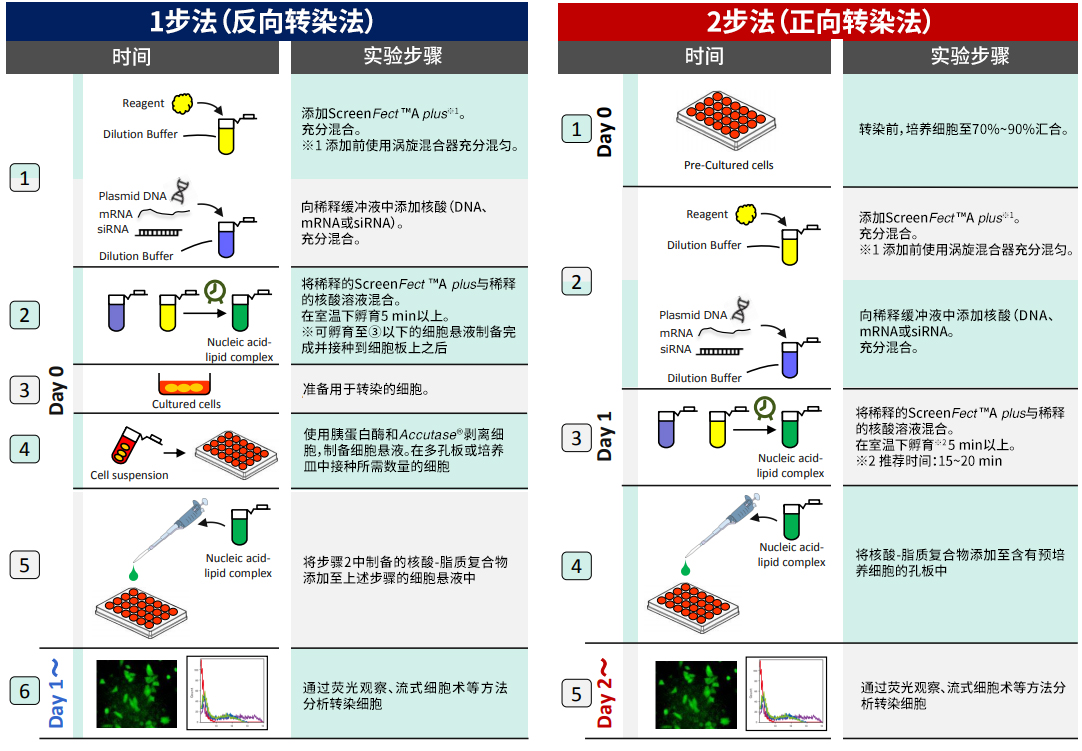
1步法 → 从转染到本分析的时间可缩短24 h!
ScreenFect ™A plus 转染条件
DNA转染
DNA 转染 (/well) | |||||
孔板类型 | 表面积 | 培养基体积 | SF-DNA 复合物的总体积 | DNA /稀释buffer | 转染试剂 /稀释buffer |
96 wells | 0.3 cm2 | 100 µL | 10 µL | 50 ng/5 μL | 0.15 or 0.2 μL/5 μL |
24 wells | 2 cm2 | 500 µL | 50 µL | 250 ng/25 μL | 0.75 or 1.0 μL/25 μL |
12 wells | 4 cm2 | 1,000 µL | 100 µL | 500 ng/50 μL | 1.5 or 2.0 μL/50 μL |
6 wells | 10 cm2 | 2,000 µL | 250 µL | 1,250 ng/125 μL | 3.75 or 5.0 μL/125 μL |
注:进行大规模转染时,请在转染前准备多个微管,之后再进行转染。
例:10 cm培养皿转染相当于 → 5~6个样品(6孔板)
▼ ScreenFect ™A plus 推荐实验方案
产品随附的说明书中提供了简易的实验方案,请确认“相关资料”中的文件。
ScreenFect™A plus推荐使用1步转染法。在试剂方面,为保证充分的转染效率,推荐质粒DNA与转染试剂的混合比例为1 : 3~1 : 4。另外,如希望进一步抑制转染时的细胞毒性,请使用60~80%汇合度的细胞。
siRNA转染
siRNA 转染 (/well) | |||||
孔板类型 | 表面积 | 培养基体积 | SF-siRNA 复合物的总体积 | siRNA /稀释buffer | 转染试剂 /稀释buffer |
96 wells | 0.3 cm2 | 100 µL | 10 µL | 1 pmol/5 µL | 0.1~0.3 µL/5 µL |
24 wells | 2 cm2 | 500 µL | 50 µL | 5 pmol/25 µL | 0.5~1.5 µL/25 µL |
12 wells | 4 cm2 | 1,000 µL | 100 µL | 10 pmol/50 µL | 1.0~3 µL/50 µL |
6 wells | 10 cm2 | 2,000 µL | 250 µL | 25 pmol/125 µL | 2.5~7.5 µL/125 µL |
注:虽然ScreenFect ™A plus也可以用于siRNA转染,但更推荐使用ScreenFect ™ siRNA 进行siRNA转染。
拥有ScreenFect ™A & A plus 应用实例的细胞
更多详细资料请联系富士胶片和光。
No. | 细胞名称 | No. | 细胞名称 | No. | 细胞名称 | No. | 细胞名称 |
1 | 143BTK | 22 | GP2-293 | 43 | LLC-MK2 | 64 | OLHNI-2 |
2 | 786-O | 23 | H9C2 | 44 | LO2 | 65 | Mouse overy cell |
3 | A2058 | 24 | HCT116 | 45 | LoVo | 66 | PC12 |
4 | A375 | 25 | HEK293 | 46 | MC3T3 | 67 | Plat-E |
5 | A549 | 26 | HEK293 TN | 47 | MC3T3-E1 | 68 | PLC8024 |
6 | B16 | 27 | HEK293A | 48 | MCF-10 | 69 | Primary Fibroblast |
7 | B16F10 | 28 | HEK293F | 49 | MCF-10A | 70 | RAW264.7 |
8 | Ba/F3-CH1 | 29 | HEK293FT | 50 | MCF-7 | 71 | SH-SY5Y |
9 | BEAS-2B | 30 | HEK293T | 51 | MDCK | 72 | SK-Hep1 |
10 | BEL-7402 | 31 | HeLa | 52 | MEF | 73 | SKOV3 |
11 | BT549 | 32 | HeLa S3 | 53 | mES | 74 | T98G |
12 | C2C12 | 33 | HEp-2 | 54 | mHSC | 75 | TE-13 |
13 | Cell line from killifish 来自鳉鱼的细胞系 | 34 | HepG2 | 55 | Microglia 小胶质细胞 | 76 | THP-1 |
14 | CHO-K1 | 35 | hiPSC | 56 | MLEC | 77 | U-251 MG |
15 | COS-7 | 36 | HK2 | 57 | MS-1 | 78 | U2OS |
16 | DB lymphoma DB淋巴瘤 | 37 | HKC | 58 | Myeloid dendritic cell (MDC) 骨髓树突状细胞 | 79 | U937 |
17 | DC 2.4 | 38 | HL7704 | 59 | NB1RGB | 80 | Vero |
18 | Du145 | 39 | HuH-7 | 60 | NCI-H1703 | 81 | Drosophira ovary somatic cell |
19 | EL4 | 40 | HUVEC | 61 | NE3 | 82 | HT1080 |
20 | Endothelium cell 内皮细胞 | 41 | Ins-1 | 62 | NIH 3T3 | 83 | RH7777 |
21 | EPC(carp) | 42 | L428 | 63 | NK92 | 84 | HaCaT |
富士胶片和光将实时更新ScreenFect™数据库中的使用实例,如对上述内容有疑问,欢迎随时联系进行咨询。
一步法和两步法实验流程的比较
产品名称 | ScreenFect ™ A plus | A厂家新产品 (+试剂) | A厂家产品 |
推荐的实验流程 | 一步法 | 两步法 | |
实验用时 | 2天 | 3天 | |
所需DNA量 | 低 | 高 | |
细胞数目调整 | 灵活 | 不灵活 | |
胰酶消化 | 需要 | 需要 | |
适于高通量筛选 | +++++ | + | |
培养基的更换 | 取决于细胞系 | ||
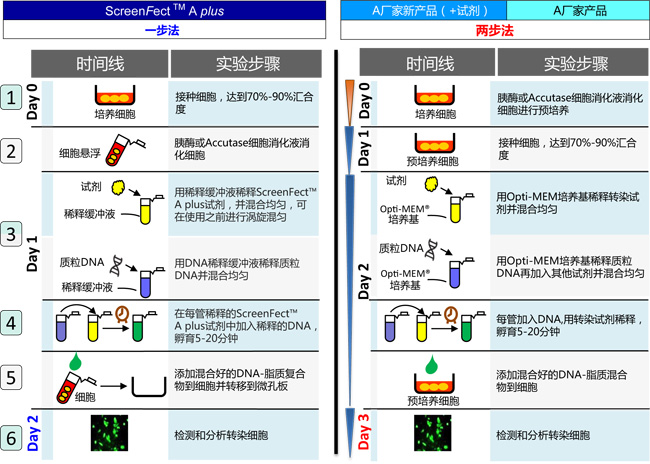
一步法比两步法节省24小时!
高性价比的高性能基因导入试剂
ScreenFect ™ 通信
基因导入人 iPS 细胞实验数据
介绍使用 ScreenFect ™A plus 将基因导入人iPS细胞的实验结果和操作步骤。本文记载了作为 iPS 细胞支架使用的 Matrigel 孔板包被方法、配制含有 Y-27632 的细胞悬浮液的操作步骤以及最优的试剂比例,供您参考。
◆导入人iPS细胞(201B7株)的转染操作实例
在这里,我们将介绍一些使用 StemSure® hPSC 培养基Δ(产品编号:197-17571)的操作实例。该操作步骤的完整版和使用 mTeSR1 培养基的操作步骤,请查看 FUJIFILM Wako 公司的官网。http://db.screenfect.jp/ja/documents/list/protocol
<转染试剂的配制>
将 2.0 μL 的 ScreenFect ™ A plus reagent、4.0 μg 的质粒 DNA 加入到 160 μL 的 Opti-MEM 中制成 DNA-lipid complex。
< Matrigel 包被孔板>
1. 4°C下溶解 Matrigel hESC-Qualified Matrix 。为防止发生凝固,请避免在室温下溶解。
2. 用 25 mL 冷却的 D-MEM/Ham's F-12 稀释 300μL 的 Matrigel。
3. 稀释后的 Matrigel 溶液按照 1 mL/well 加入到 12 孔板中。
4. 在室温下孵育1小时以上。
<细胞悬液的配制>
1. 将 StemSure® hPSC 培养基Δ在 2-8℃ 下放置数小时或过夜缓慢融解。不要在 37° C下解冻,并在一周内使用。
2. 将 bFGF(产品编号:064-05381,068-05384)按照终浓度 35-100ng/mL 添加到融解后的 StemSure® hPSC 培养基△中,配制成完全培养基(以下称为 sshPSC 培养基)。
3. 使用前将 sshPSC 培养基恢复至室温。不要使用温水浴。
4. 将 Y-27632 按照终浓度 10 μmol/L 添加到 sshPSC 培养基中(以下称为 ROCKi+培养基)。
5. 去除 hiPS 细胞培养孔板中的培养基,用 PBS(-)清洗细胞一次。
*请在细胞汇片达到80%且处于对数增殖期时进行细胞转染。
6. 除去 PBS(-),添加 Stempro Accutase。
7. 在 37°C,5%CO2 培养箱中静置5分钟。
8. 用 1 mL 微量移液枪添加 ROCKi+培养基,将细胞从培养板上分离并吹散成单细胞。
9. 转移至 15 mL离心管中。
10. 室温下 1000 rpm(约170×g)离心3分钟。
11. 去除上清,用ROCKi+培养基重悬细胞。
12. 计算活细胞的数量。
13. 用 ROCKi+培养基将细胞浓度调整至 5×105 cells/mL。
<转染>
添加 1 mL 配制好的 DNA-lipid complex 到细胞悬液中,使用移液器充分混匀,并接种在 12 孔板中。
※要点
接种 24 小时后请更换培养基。此时的培养基不需要含有 Y-27632。
◆实验数据
通过反向转染(1-STEP)将 GFP 融合基因导入 hiPS 细胞(201B7株),并通过荧光显微镜比较基因的导入效率。
<StemSure® hPSC 培养基Δ的使用>
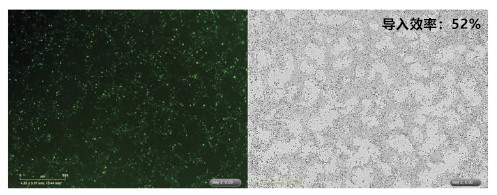
细胞数:5×105 cells/well
质粒 DNA 量:4 μg/assay
转染试剂混合比例:DNA 量(μg):ScreenFect ™ A plus reagent (μL)=1 : 0.5
容器:12 孔板
备注:用 Opti-MEM 稀释 ScreenFect ™ A plus reagent 和 DNA。
<mTeSR1 培养基的使用>

细胞数:5 x 105 cells/well
质粒 DNA 量:1 μg/assay
转染试剂混合比例:DNA数量(μg):ScreenFect ™ A plus reagent (μL)=1 : 2
容器:12 孔板
备注:用 Opti-MEM 稀释 ScreenFect ™ A plus reagent 和 DNA。
◆使用上的注意
● 建议在单细胞状态下进行人iPS细胞的基因导入。
● 建议基因导入时的细胞数约为 5×105 cells/well。
● 当质粒 DNA 量多时,导入基因的表达量高会引起细胞死亡。

Q1. 基因导入效率低怎么办?
A1. 通过优化DNA量和试剂用量可提高效率。点击右方链接查看优化Protocol(日语版,英语版)。此外,使用ScreenFect™和SFA P-reagent(产
A1. 品编号:191-18331)也可提高基因导入效率。
Q2. 如何提高表达效率?
A2. 使用ScreenFect™和SFA P-reagent(产品编号:191-18331)可提高表达水平。
Q3. 转染试剂对细胞毒性强怎么办?
A3. 使用ScreenFect™和SFA P-reagent(产品编号:191-18331)可降低细胞毒性。
Q4. 从哪些条件实验开始比较好?
A4. 点击右方链接可参考各ScreenFect™产品的快速Protocol(日语版,英语版)。
Q5. 转染过程是否需要更换培养基?
A5. 更换培养基不是必须的,但在添加转染试剂前更换新鲜的培养基可提高基因导入效率,改善细胞状态。
Q6. 培养基中能否含有血清和抗生素?
A6. 根据细胞类型、DNA导入量等因素,可能需要更换培养基,以适时控制培养基含或不含血清/抗生素。请根据实验用途进行讨论。
Q7. 1-Step、2-Step是什么?
A7. 1-Step是一种反向转染方法,即转染前通过在细胞分离状态下添加试剂来导入基因。
A7. 2-Step是一种正向转染法,即提前一天进行细胞的预培养,然后在细胞上添加转染试剂后导入基因。
Q8. 能否同时导入多个基因?
A8. 可以。请准备多种耐药性基因,推荐使用pEBMulti 和 pCAG。
Q9. ScreenFect ™A和ScreenFect ™A plus分别适用于哪种情况?
A9. 通常情况下推荐使用基因导入效率高的ScreenFect ™A plus。但如果其对细胞毒性强或与ScreenFect™A plus相比无性能差异时,推荐使用细胞
A1. 毒性低且价格实惠的ScreenFect ™A。
Q10. 需要转染siRNA时,推荐使用哪种ScreenFect ™?
A10. 可使用ScreenFect ™ siRNA。视情况,ScreenFect ™A plus也能有效转染siRNA。使用ScreenFect ™siRNA无法达到预期结果时,可考虑
A11. 两种试剂一同使用。
Q11. 需要转染mRNA时,推荐使用哪种ScreenFect ™?
A11. 可使用ScreenFect ™mRNA。与SFA P-reagent一同使用时,可有效转染mRNA,提高表达水平。
A11. 此外,ScreenFect ™A plus和SFA P-reagent共同使用的最适场景因细胞而异,部分情况下两者共同使用能达到最佳效果。单独使用
A11. ScreenFect ™mRNA无法达到预期结果时,可考虑上述两种试剂一同使用。
Q12. SFA P-reagent是什么?
A12. 将质粒DNA或mRNA导入各种细胞时,SFA P-reagent和ScreenFect ™一同使用可提高细胞导入率和转染分子的表达水平。此外,已确认添加
A11. SFA P-reagent还能显著降低转染试剂的细胞毒性。
Q13. 有在哪些细胞中的应用实例?
A13. 已在通用细胞系(HeLa、HepG2、MDCK、MCF-7、K562 等)、干细胞、造血细胞(巨噬细胞、THP-1、RAW264.7 等)、小胶质细胞、
A11. 原代细胞、昆虫培养细胞、鱼类培养细胞及其他细胞中实现基因导入。
Q14. 是否可提供试用装?
A14. 欢迎向我们联系并填写表格申请试用装。
Q15. ScreenFect ™是什么试剂?
A15. ScreenFect ™是一种由新型阳离子脂质体构成的转染试剂。
Q16. 冷冻存储会对产品性能有影响吗?
A16. 请勿使用冷冻后的产品。
Q17. 如何调整所用的质粒DNA?
A17. 推荐使用阴离子交换柱或氯化铯密度梯度离心法纯化的质粒DNA。
Q18. 血清会影响基因导入吗?
A18. 血清不会影响本产品的性能,但建议转染时避免使用EDTA 和硫酸葡聚糖等阴离子抑制剂。此外,转染时避免使用抗生素也可提高转染效率。
[1] | Diefenbacher, Markus E., et al. "The LIM Domain Protein nTRIP6 Recruits the Mediator Complex to AP-1-Regulated Promoters." PLoS ONE 9.5 (2014): e97549. |
[2] | Freise, Christian, and Uwe Querfeld. "Inhibition of vascular calcification by block of intermediate conductance calcium-activated potassium channels with TRAM-34." Pharmacological Research (2014). |
[3] | Hagiwara, Akane, et al. "Luteinizing Hormone-Induced Expression of Ptger4b, a Prostaglandin E2 Receptor Indispensable for Ovulation of the Medaka Oryzias latipes, Is Regulated by a Genomic Mechanism Involving Nuclear Progestin Receptor." |
[4] | Peng, Yanyan, Ruidan Xu, and Xiaofeng Zheng. "HSCARG Negatively Regulates the Cellular Antiviral RIG-I Like Receptor Signaling Pathway by Inhibiting TRAF3 Ubiquitination via Recruiting OTUB1." PLoS pathogens 10.4 (2014): e1004041. (3) |
[5] | Wakimoto, Hiroaki, et al. "Targetable signaling pathway mutations are associated with malignant phenotype in IDH-mutant gliomas." Clinical Cancer Research (2014). (2) |
[6] | Fischer, Simon, et al. "Breaking limitations of complex culture media: Functional non-viral miRNA delivery into pharmaceutical production cell lines." Journal of biotechnology 168.4 (2013): 589-600. |
[7] | Bai, Dongmei, et al. "Regulation of the HDM2-p53 pathway by ribosomal protein L6 in response to ribosomal stress." Nucleic acids research 42.3 (2014): 1799-1811. |
[8] | Liu, Xing, et al. "Isocitrate dehydrogenase 2 mutation is a frequent event in osteosarcoma detected by a multi‐specific monoclonal antibody MsMab‐1." Cancer medicine 2.6 (2013): 803-814. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 293-73201 | ScreenFect™ A | 0.2 mL | - | - |
| 299-73203 | ScreenFect™ A | 1 mL | - | - |
| 297-73204 | ScreenFect™ A | 1 mL×5 | - | - |
| 293-75901 | ScreenFect™ mRNA | 0.2 mL | - | - |
| 299-75903 | ScreenFect™ mRNA | 1 mL | - | - |
| 299-75001 | ScreenFect™ siRNA | 0.2 mL | - | - |
| 295-75003 | ScreenFect™ siRNA | 1 mL | - | - |
| 290-80203 | ScreenFect™ UP-293 | 1 L用 | - | - |
| 294-80201 | ScreenFect™ UP-293 | 100 mL用 | - | - |
| 191-18331 | SFA P-reagent | 100 μL | - | - |
| 197-18333 | SFA P-reagent | 500 μL | - | - |
| 194-18181 | ScreenFect™ Dilution Buffer | 50 mL | - | - |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |