DsDD cDNA Subtraction Kit(富士胶片和光新推)
双链特异性直接消化cDNA削减试剂盒
无需断片即可削减Tester cDNA。
DsDD(Duplex-specific Direct Digestion)cDNA Subtraction Kit Wako是从cDNA库通过削减法配制Tester和Driver cDNA。利用Tester和cDNA混合形成组织非特异性表达的基因,再通过双链特异性DNA核酸酶-Duplex-specific nuclease分解杂交cDNA。分解后,用ExonucleaseⅠ分解去除残留Driver cDNA,从而实现在Tester cDNA中高效浓缩特异性表达的cDNA。
本品用作解析癌细胞组织特异性功能和性质时,Tester cDNA从癌细胞组织、而Driver cDNA从正常细胞中提取,可浓缩来自癌细胞组织特异性表达的基因的cDNA 。DsDD cDNA Subtraction Kit 中的cDNA库 可作为起始材料,全部工序完成仅需2天,是划时代的技术。
◆特点
● 可从cDNA库制作
● Tester和Driver的优异选择性
● 采用Duplex-specific nuclease去除法
● 操作简单,作业工序仅需2天
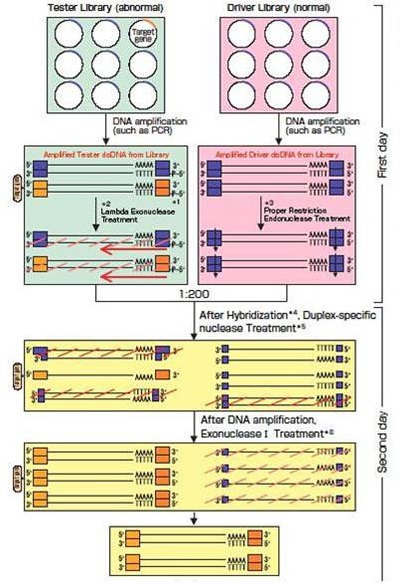
◆试剂盒原理
| 准备Tester cDNA库和Driver cDNA库。在Tester cDNA库中,cDNA插入方向要与载体一致。 1.扩增Tester cDNA 扩增DNA中在5’端添加磷酸引物使用。 2. λ 核酸外切酶处理 识别双链DNA 5’端磷酸化引物并从5’到3’开始降解。Tester没有杂交,削减效率加 强。 3.限制性内切酶处理 消化两端的接头保证准确的杂交结果。 4.杂交 Tester cDNA和Driver cDNA在68℃中反应16-20小时(混合比率=1:200)。过量的Driver cDNA使大部分Tester cDNA形成单链DNA。 5.双链特异性核酸酶处理 酶特异性酶切单链DNA。高反应温度(68℃)保证反应的特异性。 6.核酸外切酶 I处理 酶特异性酶切单链DNA。非特异性基因为单链,然后被降解。反应后,Tester能特异性表 达基因的单链DNA能保留。 此高效cDNA削减方法完成仅需2天。 |
◆使用案例
利用人肝癌来源的HepG2细胞和人正常肝脏来源的cDNA库,对高表达管家基因-GAPDH和HepG2细胞中特异性表达的AFP基因进行削减。
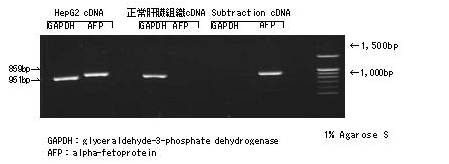
在HepG2 cDNA和正常肝脏cDNA都能检测出GAPDH的条带,但Subtraction cDNA没有检测出条带。另外,正常肝脏组织cDNA没有检测出AFP条带,但在Subtraction cDNA中能检测到与HepF2 cDNA同等亮度的AFP条带。通过本方法得到的Subtraction cDNA能高效浓缩HepG2的特异性表达基因。
Q&A
Q: DsDD cDNA Subtraction Kit做什么的试剂盒?
A: 将需要做比较的cDNA库用PCR进行扩增制备Tester和Driver cDNA,对DNA扩增产物进行削减的试剂盒。与传统方法相比,操作更简便,实
验时间也仅需2天时间。可以将现有的cDNA库或市面售卖的cDNA库直接开始进行实验,这是传统方法所不能做到的。而且最终制备出来的
Subtraction cDNA是混入管家基因较少的cDNA,可以直接应用于各种用途。
Q: DsDD cDNA Subtraction Kit有什么优点?
A:● 直接使用现有的cDNA,全部工序完成仅需2天。
A:● 全程在DNA状态下进行,无需熟练的操作技术。cDNA的制备有非常高的选择性。
A:● 可以通过市面或用户自己准备的质粒cDNA来制备。
A:● 除了质粒以外,还可以从5’和3’端带接头的cDNA制备cDNA。
A:● 操作简便
A:● 最终制备出来的Subtraction cDNA反映最初所用的Tester cDNA。因为Tester没有经过限制性内切酶处理,所以一开始的Tester cDNA可
以反映最终制备的Subtraction cDNA的状态。原理上,在载体库使用全长cDNA,就能反映Subtraction cDNA的全长。
A:● 只要改变Tester和Driver,就能进行反向削减。
A:● 制备的Subtraction cDNA可以立刻应用于各种用途。
A:● 制备的Subtraction cDNA中,混入管家基因的量少,所以它还可以作为载体亚克隆(系统序列)和DNA芯片的探针使用。
Q: 与PCR-Select法有什么不同?
A:
起始材料 | 接头添加 | 杂交次数 | house-keeping基因污染 | |
DsDD法 | cDNA库或5’和3’末端带接头的cDNA | 不必要 | 1次 | 已经分解去除,污染小 |
PCR-Select法 | RNA | 必要 | 2次 | 未经分解去除,有污染的可能性 |
● PCR-Select法每次都需要通过RNA制备cDNA,DsDD法则只需cDNA库就能进行实验。另外,采用PCR-Select法必须用Rsal(4碱基内切酶)
酶切,将低分子化的接头分子与3’或5’端结合。而DsDD不需要。因此最终的Subtraction cDNA能反映最初的Tester cDNA的状态。
● PCR-Select法需要进行两次杂交,而DsDD法只需一次。
● PCR-Select法需要从大量cDNA样品中用Supression-PCR对SubtactedcDNA进行特异性扩增,而DsDD法则是通过对与管家基因等共同表达
的基因进行杂交后,用分解去除的方式,极力减少管家基因的污染。DsDD法的原理上是形成Subtraction cDNA群,因此可以直接应用于克
隆和DNA芯片的制作。
Q: 操作DsDD法时,特别需要注意的事项是什么?
A:1. 使用Tester,运用单向插入的cDNA库。
Tester的cDNA库,必须对载体使用单向插入的cDNA库。若不用单向cDNA库,即使是用λ核酸外切酶处理成单链,有意链和反意链的
cDNA会混为一体,Tester聚集杂交,是降低Subtraction效率的主要原因。
A:2. 使用去除低分子DNA的色谱柱
DSN(Duplex-specific nuclease)是8bp以上的完全一致的双链DNA分解酶,因此其短断片残留多。在乙醇沉淀中,无法去除这些断片
或引物。引物残留的非特异性杂交,是DSN的非特异性分解的原因。DSN的分解产物在最后的PCR时,变成非特异性引物,是形成低分
子断片等非特异性断片增加的原因。
A:3. 用乙醇共沉淀时,务必使用配套的Ethachinmate(乙醇沉淀核酸载体)
共沉淀时使用tRNA等核酸,会与Tester cDNA发生非特异性杂交。引起DSN的非特异性分解。
而Ethachinmate(乙醇沉淀核酸载体)是聚丙烯酰胺类的共沉淀剂,DNA回收率高达100%。即使通常不可见的沉淀也可以变为可见,
在操作移液器时避免误吸。
A:4. 使用适用于1 μL的移液器。
A :1 μL的移液操作时,尽可能使用合适的吸移管操作(如Gilson公司的PIPETMAN 2P)。特别是在进行杂交时,Tester ssDNA和Driver
dsDNA需要注意移液操作。这一操作中,Tester:Driver=1:200这一比率的把握尤为重要,尽可能减小在移液移过程中的误差。
A:5. 酶反应时使用PCR管。
说明书记载DNA扩增反应应尽可能使用PCR管。PCR热效率较好可以进行正确的反应。
Q: 除试剂盒外还需准备什么?
A:1. Tester和Driver扩增用的cDNA库
A:2. Tester和Driver扩增用的Primer
A:3. 参照基因扩增用Primer(GAPDH、β-Actin等)
A:4. DNA聚合酶(TOPOTAQ DNA polymerase等)
A:5. dNTP Mixture
A:6. 低分子DNA和Primer去除用色谱柱
A:7. 限定性酶
A:8. 苯酚:氯仿:异戊醇(25:24:1)
A:9. 70%、99.5%乙醇
A:10. DNA分子量marker
A:11. 琼脂糖
A:12. 溴化乙锭
A:13. 1×TAE Buffer
A:14. Loading Buffer
A:15. 灭菌蒸馏水
Q: DsDD是什么的缩写?
A: DsDD是Duplex-specific Direct Digestion(双链特异性直接消化)的缩写。通过Duplex-specific DNA Nucelase,可以特异性切断杂交形
成的DNA群。
Q: Tester和Driver是什么?
A: 特异性表达的cDNA端叫“Tester”,作为基准的cDNA一般称为“Driver”。从癌特异性cDNA库制备的cDNA为“Tester”,正常细胞
来源的cDNA库配制的cDNA则为“Driver”。
Q: 应选用何种凝胶过滤柱?
A: 可以使用能去除100bp以下的,市面售卖的凝胶过滤柱。Code No.:195-14451 Spin Cleaner
Q: 杂交一定要经过16小时么?
A: 16~20小时都是没有问题的。建议16个小时是因为考虑到从实验当天17点开始进行杂交的话,第二天上午9点就可以进行下一项操作。
Q: 按照protocol制备Driver ds cDNA,但还是不能配出200 ng/μL的浓度,应该如何解决?
A: 浓度比较小的时候,请用乙醇共沉淀法操作。离心管中加入Tester 1 ng、Driver 200 ng后,加入无菌水100 μL,Ethachinmate 1μL,
3mol/L的Sodium Acetate 10 μL,乙醇250 μL,振荡混合后进行离心。然后去除上清,加入150 μL 70%的乙醇离心后,去除上清,干
燥,再加入3 μL的灭菌蒸馏水进行溶解。备用于杂交试验。
杂交操作中Tester:Driver=1:200的比率十分重要。乙醇沉淀导致部分DNA缺失是没有问题的。
Q: DSN (Duplex-specific nuclease)有什么优点?
A: DSN是堪察加蟹肝脏来源的新型双链特异性DNA分解酶,可在双链DNA或DNA-RNA杂交过程中特异性切断DNA。最适宜温度55~65℃,
Mg2+条件下,可用EDTA抑制其活性。因为DSN能在高温环境下进行反应,所以在DsDD法中,进行严格性较高的杂交反应。
Q: 一定要使用PCR管吗?
A: 说明书记载DNA扩增反应应尽可能使用PCR管。热效率较好能进行正确的反应。
Q: Drive ds cDNA的限定性酶处理是必要的么?
A: Tester和Driver的载体相同时,需要进行限定性酶处理。目的是防止因Primer结合引起非特异性杂交而导致DSN分解。用限定性酶只剪切
Tester和Driver的cDNA,相辅的cDNA杂交。通过改变Tester和Driver端的Primer set,进而减少非特异性杂交。
Q: 扩增的Tester和Driver侧的Primer set可以是相同的吗?
A: 同一Set也可以,但不是酶处理本身100%的反应。未处理的Driver cDNA Primer和Tester sscDNA的Primer结合,会通过DSN被分解。
为了防止上述情况,建议扩增Tester和Driver端的PrimerSet还是要区分开。
Q: 限定性酶处理时如果出现Driver cDNA的内部被切断的话,会有影响吗?
A: 没有影响。即使被切断了,还是能与Tester sscDNA进行杂交。
Q: 一定要进行Exonuclease I处理吗?
A: 不是必要的操作。对Subtraction cDNA使用标记探针时,Exonuclease I能分解Driver的cDNA,可降低背景。
Q: 最后,扩增削减cDNA用到的Primer需要进行磷酸化吗?
A: 不用,而是需要合成新的Primer。可以的话,建议使用最初的Primer内侧区域的Primer进行PCR操作。
Q: 配制Tester cDNA和Driver cDNA时使用的plasmid DNA会有影响吗?
A: 没有影响的。DsDD法用的是双链特异性DNA分解酶(DSN),可分解plasmid DNA,所以不会影响。像生物素结合法、乳胶微粒oligo
(dT)固相法这些传统方法,无法去除plasmid DNA,才会对转换和探针的制备等产生影响。
Q: 说明书推荐的TOPOTAQ DNA polymerase有什么特点?
A: 本产品是Pyrococcus DNA polymerase和Taq DNA polymerase来源的催化结构域和甲烷细菌Methanopyruskandleri来源的非特异性
DNA结合域融合的新型耐热性DNA Polymarase。本酶家族带有拓朴异构酶活性。通过这个特性,仅通过酶反应就能扩增GC-rich领域。
这是目前其他酶都无法轻易做到的。TOPOTAQ DNA polymerase有热启动功能,能抑制非特异性的扩增。
Q: Ethachinmate是什么?
A: Ethachinmate由NipponGene生产的,在核酸(DNA或RNA)被乙醇或异丙醇沉淀时使用的高分子载体。使用本品,能从浓度低的核酸
溶液中定量回收微量核酸。加入乙醇或异丙醇后,无需进行-20℃或-80℃冷却,可直接离心。回收的核酸用缓冲液溶解后,可直接作为各
种酶的基质使用。
Q: 去除的Subtracted cDNA有多大?
A: 和光确认的大小为500~1500bp。最初用的cDNA库和DNA扩增的的延伸时间会影响Subtracted cDNA的大小。
Q: Subtraction的效率是多少?
A: Tester端用肝癌细胞HepG2来源的cDNA,Driver端用人正常肝脏组织由来cDNA的话,Real-time PCR过程中GAPDH会被抑制至1/1,000。
Q: 对削减的基因进行亚克隆化,什么方法比较好?
A: 一般采用的方法是:TA克隆或限定性酶处理后,插入目的载体,进行转换。
Q: 证明cDNA削减的方法是什么?
A: 配制的Subtracted cDNA经过TA克隆后,在菌落PCR确认插入断片,接合探针,通过其在市面售卖的mRNA点膜上的斑点,判断是否有组
织特异性基因存在的。还可以在数据库搜索序列,或解析DNA芯片的方法。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 294-62001 | DsDD cDNA Subtraction Kit Wako | 5次用 | - | - |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |