培养基定制

FUJIFILM Wako 爱知工厂是具有 GMP 级管理的培养基专用工厂。
结合试剂实业培养的原料供应线,和有效利用化工业部培养的药品原料制造技术,承接抗体药品和疫苗等生物药品制造以及再生医疗用粉末,以及液体培养基等定制。
◆富士胶片和光纯药GMP级管理
● 参考 ICH 的原药指南(Q7)合理管理和运用培养的制造。
● 建筑物、储存室中检验制造、分析、清洗方法。
● 粉末培养基原料使用的是高品质且来源明确的原料。
◆特点
● 可溯源
● 粉末培养基区域不使用动物源原料进行了彻底改革管理
● 品质管理
● GMP 级别体制(各种有效性检查文件管理)
● 应用范围广
● 设计研究开发、实验生产、广告产业
● 日本生产
● 灵活协调客户需求
◆生产能力·生产环境
粉末设备包括数kg小规模设备、数百kg中度规模设备。构建了从实验规模到商业规模制造的流程。
液体是在GMP级管理的无尘室内制造。
液体培养基、培养基添加剂、buffer等使用焊床及封口机进行无菌充填包装。
粉末培养基 | 液体培养基 | ||
GMP级生产 | non- GMP级生产 | GMP级生产 | |
生产规模 | 400~1000 kg/B | 1~100 kg/B | 1 L~1500 L/B |
生产环境 | 10万级、防虫 | 室内空调、防虫 | 100~10万级、防虫·细菌 |
◆有效性检查(仅限GMP级生产)
在爱知工厂,与医药品的制造管理以及品质管理相关的有效性检查业务制定运用的是《有效性检查标准书》和《有效性检查实施计划书等制定程序书》。

《基本有效性检查》
● 工艺验证
● 清洗检查
● 分析法检查
※关于各种有效性检查需要与客户协商确定。
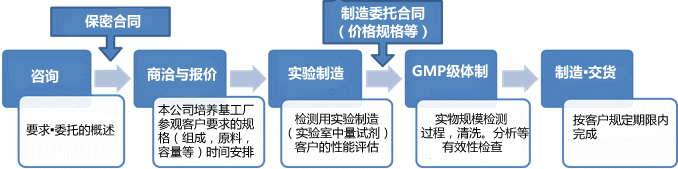
◆定制流程
◆相关产品
植物组织培养用培养基
液体培养基/细胞培养试剂
液体培养基
StemSure®人多能性干细胞无血清培养基Δ
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |