LBIS® 抗dsDNA-小鼠ELISA试剂盒![]()
LBIS® Mouse Anti-dsDNA ELISA Kit
近年来研究人员多通过使用与人具有同样的自身免疫性疾病的实验动物自然发病和人为使实验动物发症的方式来研究自身免疫性疾病的机制阐明和新型药物开发。自然发病系统代表的MRL/lpr小鼠被应用到很多实验。MRL/lpr小鼠在淋巴结肿瘤发病同时伴随着肾炎、血管炎、关节炎的高机率发病,对包含慢性风湿性关节炎(RA)模型的自身免疫性疾病发病机制的阐明,可作为有效的模型进行研究。MRL/lpr小鼠血清中被检测出自身抗体有IgG型类风湿因子(RF)、IgM型类风湿因子(RF)、抗ssDNA 抗体、抗dsDNA 抗体、抗Sm 抗体。
通过使用该疾病动物血清中自身抗体含量做标准曲线,通过单位转换,可进行测量之间数值的比较。
LBIS® 抗dsDNA-小鼠ELISA试剂盒采用了测定小鼠抗dsDNA 抗体浓度的夹心酶联免疫测定法。
此试剂盒仅限研究使用。
◆特点
● 全反应时间是4小时20分钟。
● 测定小鼠血清或者血浆(肝素血浆除外)中的抗dsDNA 抗体浓度。
● 可测定微量样本(标准操作法是5 μL)。
● 1个试剂盒可做96孔。
● 标准品是小鼠源。
● 全部试剂均为液体。
试剂盒的保存和使用期限
试剂盒在2-8℃保存。此保存条件下,有效期(记载在外箱标签)内试剂盒是稳定的。开封的试剂对应保存状态可能会受到影响,请尽早使用。
◆测定原理
本试剂盒是标准品、稀释样本在抗原包被的微孔板中进行孵育处理。孵育2小时后清洗,加入过氧化物酶结合抗小鼠IgG抗体,与捕捉的抗体孵育2小时。清洗后,显色剂(TMB)与孔中残留的过氧化物酶反应。添加酸性溶液可终止反应。反应生成的黄色产物在450 nm处(副波长620 nm)测定。吸光度与抗小鼠dsDNA 抗体浓度成正比。标准品浓度对应吸光度可制作成标准曲线。通过标准曲线获得未知样本浓度。
◆试剂盒组成
组成 | 状态 | 包装 |
(A)抗原包被96孔板 | 直接使用 | 96 wells((8×12)/个) |
(B)标准抗小鼠dsDNA 抗体溶液(10000 mU/mL)※ | 浓缩液 | 100 μL/瓶 |
(C)缓冲液 | 直接使用 | 60 mL/瓶 |
(D)标记抗体 (过氧化物酶结合抗小鼠IgG抗体) | 浓缩液 | 20 μL/瓶 |
(E)显色液(TMB) | 直接使用 | 12 mL/瓶 |
(F)终止液(1M H2SO4)※注意操作 | 直接使用 | 12 mL/瓶 |
(G)浓缩清洗液(10×) | 浓缩液 | 100 mL/瓶 |
盖板 | 1 个 | |
操作说明书 | 1 本 |
※根据批次不同,数值有差异。
◆所需必要设备
● 蒸馏水。
● 标准溶液稀释用试管。
● 清洗液(稀释用溶液)用玻璃器具。(量筒·瓶)
● 枪头交换式移液器。(一次性枪头5 μL正规的移液枪,以及50-450 μL正规的移液枪)
● 连续分装移液枪。(例:Eppendorf 的multipette plus、可进行100 μL连续分装的仪器。)
● 纸巾等吸水性物品。(清洗后去除板上残留液体)
● 搅拌器。(Vortex类型)
● 96孔板用振荡器。(约800 rpm)
● 96孔板用清洗机(若有是最好)或者注射瓶。
● 96孔板酶标仪。(450 ±10 nm 、620 nm:600~650 nm)
● 数据分析用软件。(若有是最好)
● 测定范围
● 小鼠抗dsDNA 抗体检测范围在15.6-1000 mU/mL内。
● 特异性
● 本ELISA系统使用的标识抗体对抗小鼠IgG抗体具有特异性。
● 与小鼠IgM的反应交差性在检测灵敏度以下。
● 精密度实验
● ①批次变动(N=30)平均C.V.值是4.2%
● ②日差可重复性实验(N=30、3天)平均C.V.值是4.7%
欲了解更多相关产品信息,请点击文字:LBIS® 疾病相关动物模型ELISA试剂盒系列
相关资料
● 本试剂盒需要由掌握ELISA 法技术的人员,或者是在技术人员指导下使用。
● 手动操作测定时请使用对可重复性较稳定的移液器。
● 准备工作以及本试剂盒操作中,请穿戴手套,眼镜,保护服。
● 试剂类请不要接触皮肤。误将本试剂盒的试剂接触眼睛、口腔、伤口、皮肤等情况请立即进行应急处理,如用 ● 自来水彻底冲洗,必要时请就医。
● 使用本试剂盒的空间请不要进食和吸烟。
● 本试剂盒含有动物源成分。与测定样本一样可能会有感染的危险性,操作需要注意。
● 请不要使用加热灭活样本。
● 抗凝剂请使用除肝素以外试剂。
● 试剂类请勿入口。
● 批次号不同的产品请不要混合使用。
● 各步骤静置反应时,为防止板孔干燥、异物混入、分装试剂蒸发。请必须盖上盖板。
● ELISA法会受到测定环境影响的。测定操作、静置反应的室温严格控制在:20~25℃(实验台上或者是恒温箱 ● 内温度)。另外,避免在风速(也包括空调风)0.4 m/sec*以上,湿度不足30%的环境下测定。
*若想获取相关标准的内容请联系我们。
● 请注意样本和试剂中不要混入不纯物。建议使用1孔/1枪头。
● 显色剂在96孔板使用前是无色或者透明的。请避光保存。
● 终止液在96孔板使用前是无色的。将终止液加入到孔中,颜色立即从蓝色变成黄色。
● 不得已在风速:0.4 m/sec以上,湿度不满30%的操作环境下测定时,各步骤的静置反应均需要盖上盖板,请 ● 采取增加各孔的密闭度措施。
例:用封口膜覆盖板孔,在其上面覆盖盖板,或者在恒温箱内,泡沫塑料箱内静置反应等。要根据测定环境的条件制定出不同的对策方法。具体详细ELISA技术信息请联系我们。
● 使用完的样本,使用的消耗品等请用1%福尔马林、2%戊二醛或者0.1%以上的次氯酸钠溶液浸泡1小时。或者 ● 高压灭菌处理后废弃。另外,使用的消耗品和未使用的药品请按照规定以及法律和它所属的设施各区域的规章丢● 弃。
● 试剂盒的试剂使用前必须恢复到室温(20-25℃)
● 请按照测定所需用量制备试剂。
● 请不要使用超过有效期(外箱记载)的试剂。
室温直接使用的试剂
[抗原包被96孔板]
稳定性和保存方法
未使用(在冷藏状态下请不要撕开密封膜)抗原包被袋是同捆的拉链密封袋,请在2-8℃保存。有效期内可稳定保存。
[缓冲液]和[显色液]
稳定性和保存方法
使用部分溶液时将适量液体移至其他容器,其余请不要恢复室温,直接拧紧盖子,置于2-8℃保存。有效期内保持稳定。
[终止液(1M H2SO4)]※注意操作
稳定性和保存方法
将剩余终止液瓶盖拧紧,置于2-8℃保存。有效期内保持稳定。
浓缩试剂类
[浓缩清洗液(10×)]
浓缩清洗液(10×)用室温的蒸馏水10倍稀释,制备成实用稀释倍数1×溶液。
例:100 mL的浓缩清洗液(10×)+900 mL蒸馏水(96孔板全部使用情况下)
稳定性和保存方法
浓缩清洗液(10×)保存时要拧紧瓶盖,置于2-8℃保存。有效期内保持稳定。使用残留的稀释液请废弃。
[标准抗小鼠dsDNA 抗体溶液(10000 mU/mL)];抗体标准曲线制作用
使用标准抗小鼠dsDNA 抗体溶液(10000 mU/mL)(原液)按下表(例)制成标准溶液。
标准溶液容量 | 缓冲液 | 浓度(mU/mL) |
原液50 μL | 450 μL | 1000 |
1000 mU/mL溶液250 μL | 250 μL | 500 |
500 mU/mL溶液250 μL | 250 μL | 250 |
250 mU/mL溶液250 μL | 250 μL | 125 |
125 mU/mL溶液250 μL | 250 μL | 62.5 |
62.5 mU/mL溶液250 μL | 250 μL | 31.3 |
31.3 mU/mL溶液250 μL | 250 μL | 15.6 |
0(空白) | 250 μL | 0 |
稳定性和保存方法
拆分试剂盒使用前从冷藏柜取出稀释制备,剩余原液不要置于室温,将瓶盖拧紧后,置于2-8℃保存。有效期内保持稳定。稀释的标准溶液直接使用,请不要保存。
[标记抗体(过氧化物酶结合抗小鼠IgG抗体)]
提供充分使用量20 μL。
请将浓缩液用缓冲液稀释2000倍(推荐分2步稀释)
稳定性和保存方法
拆分试剂盒使用前从冷藏柜取出稀释制备,剩余原液不要置于室温,将瓶盖拧紧后,置于2-8℃保存。有效期内保持稳定。剩余稀释液请废弃。
本试剂盒可测定小鼠血清或者血浆中抗小鼠dsDNA 抗体浓度。样本请按照常规方法采集的血清或者血浆。除肝素以外的抗凝剂均可使用。请不要使用加热灭活样本。根据测定范围(15.6-1000 mU/mL),利用试剂盒的缓冲液稀释样本。稀释倍数为51倍,101倍,201倍。稀释样本时,预先在试管等容器用缓冲液稀释,然后分装至检测孔中。若怀疑是有干扰物质影响的标本,在同一样本情况下,请稀释100倍以上方可测定。另外,请用不同2个点以上的稀释率确定稀释直线性。浑浊以及含有难溶物的样本需要离心分离除去后方可测定。另外,请不要使用溶血样本和高脂质样本。
稳定性和保存方法
样本采集后立即测定,需要一周内测定时,请保存在2-8℃条件下。另外,长时间保存情况下需要-35℃以下冻存管保存。测定前解冻样本需要充分搅拌,避免反复冻融。此为造成得不到正确结果的原因。
[抗原包被微孔板的密封是,微孔板充分恢复到室温后方可除去。]
1.用预先制备清洗液对每孔加满清洗3遍。然后将板倒扣在纸巾上,轻轻叩击孔板除去残留液体。
2.准(抗体)溶液或者稀释样本溶液,每孔分装100 μL。
3.于微孔板振荡器充分搅拌**。
4.覆盖板盖,室温下静置2小时。
5.反应终止后,除去反应液,用清洗液对每孔加满清洗3遍。然后将板倒扣在纸巾上,轻轻叩击除去残留液体。
6.各板孔中分装标识抗体(过氧化物酶结合抗小鼠IgG抗体)100 μL,置于微孔板振荡器充分搅拌**。
7.覆盖板盖,室温下(20~25℃)静置2小时。
8.反应终止后,除去反应液,用清洗液对每孔清洗3遍*。然后将板倒扣在纸巾上,轻轻叩击除去残留液体。
9.向各孔分装显色液100 μL。置于微孔板振荡器充分搅拌**。
10.覆盖板盖,室温下(20~25℃)静置20分钟。
11.向各板分装终止液100 μL。终止显色反应。
12.将搅拌**后微孔板在分光光度计450 nm处(副波长620 nm)测定吸光度。
13.副波长是600-650 nm范围内使用。
注意
*清洗液的液量值是300 μL/孔。
使用平板清洗器的压力值:5-25 mL/分(取决于喷嘴的直径)
请注意清洗液倒出后的干燥情况。
**搅拌标准:800 rpm-10秒*3次
图1 工作表(例)
1&2列 | 3&4列 | 5&6列 | 7&8列 | 9&10列 | 11&12列 | |
A | 100 mU/mL | 阳性对照 | 样本8 | 样本16 | 样本24 | 样本32 |
B | 500 mU/mL | 样本1 | 样本9 | 样本17 | 样本25 | 样本33 |
C | 250 mU/mL | 样本2 | 样本10 | 样本18 | 样本26 | 样本34 |
D | 125 mU/mL | 样本3 | 样本11 | 样本19 | 样本27 | 样本35 |
E | 62.5 mU/mL | 样本4 | 样本12 | 样本20 | 样本28 | 样本36 |
F | 31.3 mU/mL | 样本5 | 样本13 | 样本21 | 样本29 | 样本37 |
G | 15.6 | 样本6 | 样本14 | 样本22 | 样本30 | 样本38 |
H | 0 | 样本7 | 样本15 | 样本23 | 样本31 | 样本39 |
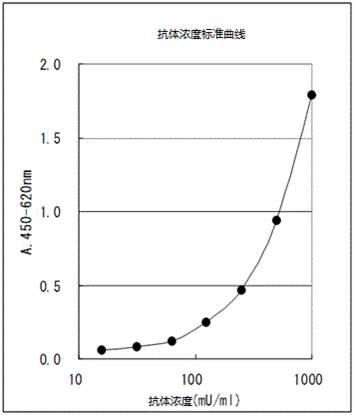
1.制作抗体标准曲线。使用半对数X轴(Log)表示抗体浓度(mU/mL),Y轴表示吸光度的抗体标准曲线。
2.通过抗体标准曲线,获得稀释样本的吸光度对应的抗体浓度(mU/mL),抗体浓度乘以稀释倍数即为测定值。
*样本的吸光度在标准曲线吸光度以外的情况,用缓冲液进行适当地稀释后再次检测。
*吸光度在标准溶液最高浓度附近的样本需要用缓冲液进行适当地稀释后再次检测。
*计算机软件演算处理推荐使用3阶多项式,或4个参数。
*本试剂盒的测定值为小鼠样本的抗dsDNA 抗体浓度较方便确定的数值,这是使用本公司同一款试剂盒,以及使用其他设备的检测的数据进行比较的数值。小鼠的临床表现是由临床症状和其他的检测结果等进行综合判断。
抗体浓度标准曲线例子。(吸光度会根据测定环境而变化)
*所用酶标仪为SUNRISE RAINBOW(TECAN)
*必须详细阅读操作说明书后再进行检测操作。
● 孔板、试剂类完全恢复到室温。
● 浓缩清洗液的稀释:用室温的蒸馏水稀释10倍。
● 标准溶液的稀释(例):用室温的缓冲液稀释。

● 阳性对照样本的制作,样本的制作。注:*最高浓度的标准溶液
抗原包被96孔板 | |
↓洗净3次* | |
稀释样本或标准(抗体)溶液 | 100 μL |
↓搅拌**,室温反应2小时(静置***) ↓清洗3次* 标记抗体(过氧化物结合抗小鼠IgG抗体) 的稀释用室温缓冲液,稀释2000倍 ↓清洗3次* | |
标记抗体(过氧化物酶结合抗小鼠IgG抗体) | 100 μL |
↓搅拌**,室温反应2小时(静置***) ↓洗净3次* | |
显色液(TMB) | 100 μL |
↓搅拌**,室温反应2小时(静置***) | |
终止液(1M H2SO4)※注意操作 | 100 μL |
↓搅拌** | |
吸光度测定(主波长450 nm,副波长620 nm) | |
室温:20~25℃ | |
*平板清洗机或者用移液枪添加清洗液时的液量值:300 μL/孔
*平板清洗机压力值:5-25 mL/分(取决于喷嘴的直径)
*请注意清洗液倒出后的干燥情况。
**搅拌标准:800 rpm-10秒*3次
**副波长请设定范围为600-650 nm。
***搅拌完毕后在96孔板上覆盖盖板后静置处理。
● 全部孔的反应很弱
可能原因
⑴ 未加入标准品和样本。
⑵ 未加入显色相关试剂溶液
⑶ 弄错显色相关试剂溶液或未稀释制备。
⑷ 混入酶抑制剂。
⑸ 试剂盒保存温度的影响(冻存情况)
⑹ 微孔板清洗过度。
⑺ 显色液温度过低。
● 空白OD值比最小标准溶液浓度(15.6 mU/mL)的OD值高。
可能原因
清洗不当,清洗不完全。
(过氧化物酶结合抗体反应后清洗次数按照同样流速增加到4-6次。)
● 变动系数(CV)大
可能原因
① 清洗不当,清洗不完全。
② 准品和管理血清或者样本搅拌不充分。(请充分搅拌冻存样本)
③ 移液器操作不一致。
Q1:试剂盒拆分之后能使用吗?
A1:可以。请使用切割工具将贴在平板的透明密封条带切割分开。不用的平板需要密封后保存在冷藏柜中。
Q2:要是取出平板时孔中有液体,究竟是什么?
A2:出货时填充的保存稳定液。
[1] | Original reports | ||||||||||||||||
Parasites alter the pathological phenotype of lupus nephritis | |||||||||||||||||
Miyake. K.., Adachi. K.., Watanabe. M., Sasatomi. Y., Ogahara. S., Abe. Y., Ito. K., Dan Justin. YK., Saito. T., Nakashima. H. and Hamano. S. | |||||||||||||||||
Autoimmunity, 24:1-10, Jun. 2014. | |||||||||||||||||
[2] | |||||||||||||||||
Kanda. Y., Kawamura. T., Kobayashi. T., Kawamura. H., Watanabe. H., Abo. T. | |||||||||||||||||
Cellular Immunology, Vol.289(1-2), p162-166, May-Jun 2014. | |||||||||||||||||
[3] | |||||||||||||||||
Yokogawa. M.,Takaishi. M., Nakajima. K., Kamijima. R., Fujimoto. C., Kataoka. S., Terada. Y. and Sano. S. | |||||||||||||||||
Arthritis & Rheumatology, Vol.66(3), p694-706, Mar. 2014. | |||||||||||||||||
[4] | Deficient Leptin Signaling Ameliorates Systemic Lupus Erythematosus Lesions in MRL/Mp-Faslpr Mice | ||||||||||||||||
Fujita. Y., Fujii. T., Mimori. T., Sato. T., Nakamura. T., Iwao. H., Nakajima A., Miki. M., Sakai. T., Kawanami. T., Tanaka. M., Masaki. Y., Fukushima. T., Okazaki. T. and Umehara. H. | |||||||||||||||||
The Journal of Immunology, Vol.192(3), p979-984, Feb. 2014. | |||||||||||||||||
[5] | |||||||||||||||||
Sasaki. M., Tojo. A., Okochi. Y., Miyawaki. N., Kamimura. D., Yamaguchi. A., Murakami. M., and Okamura. Y. | |||||||||||||||||
Biochem. J. Vol.450(2), p295-301, Mar. 2013. | |||||||||||||||||
[6] | Overexpression of Epstein-Barr virus-induced gene 3 protein (EBI3) in MRL/lpr mice suppresses their lupus nephritis by activating regulatory T cells | ||||||||||||||||
Nishimura Shinsuke and Inoue Hiroshi. | |||||||||||||||||
Autoimmunity, 2013. | |||||||||||||||||
[7] | Suppression of glomerulonephritis in lupus prone NZB/W mice by RN486, a selective inhibitor of Bruton's Tyrosine Kinase | ||||||||||||||||
P.Mina-Osorio, J.LaStant, N.Keirstead, T.Whittard, J.Ayala, S.Stefanova, R. Garrido, N. Dimaano, H. Hilton, M. Giron, K.-Y.Lau, J.Hang, J.Postelnek,Y.Kim, S.Min, A. Patel, J.Woods, M.Ramanujam, J.DeMartino, S.Narula, D.Xu. | |||||||||||||||||
Arthritis & Rheumatism, 2013. | |||||||||||||||||
[8] | Galectin-9 Ameliorates Clinical Severity of MRL/lpr Lupus-Prone Mice by Inducing Plasma Cell Apoptosis Independently of Tim-3 | ||||||||||||||||
M.Moritoki, T.Kadowaki, T.Niki, D.Nakano, G.Soma, H.Mori, H.Kobara, T.Masaki, M.Kohno, M.Hirashima. | |||||||||||||||||
PLOS one, 2013. | |||||||||||||||||
[9] | Runx1 Deficiency in CD4+ T Cells Causes Fatal Autoimmune Inflammatory Lung Disease Due to Spontaneous Hyperactivation of Cells | ||||||||||||||||
W.F.Wong, K.Kohu, A.Nakamura, M.Ebina, T.Kikuchi, R.Tazawa, K.Tanaka, S.Kon, T.Funaki, A.Sugahara-Tobinai, C.Y.Looi, S.Endo, R.Funayama,M.Kurokawa, S.Habu, N.Ishii, M.Fukumoto, K.Nakata, T.Takai and M.Satake | |||||||||||||||||
The Journal of Immunology, Vol.188(11), p5408-5420, Jun 2012. | |||||||||||||||||
[10] | Dendritic Cell-Specific Ablation of the Protein Tyrosine Phosphatase Shp1 Promotes Th1 Cell Differentiation and Induces Autoimmunity | ||||||||||||||||
T.Kaneko, Y.Saito, T.Kotani, H.Okazawa, H.Iwamura, M.Sato-Hashimoto, Y.Kanazawa, S.Takahashi, K.Hiromura, S.Kusakari, Y.Kaneko, Y.Murata,H.Ohnishi, Y. Nojima, K.Takagishi and T. Matozaki | |||||||||||||||||
The Journal of Immunology, Vol.188(11), p5397-5407, Jun 2012. | |||||||||||||||||
[11] | Autoimmune disorder phenotypes in Hvcn1-deficient mice | ||||||||||||||||
Sasaki M, Tojo A, Okochi Y, Miyawaki N, Kamimura D, Yamaguchi A, Murakami M and Okamura Y. | |||||||||||||||||
Biochem. J. Vol.450, p295-301, 2013. | |||||||||||||||||
[12] | Eradication of Metastatic Renal Cell Carcinoma after Adenovirus-Encoded TNF-Related Apoptosis-Inducing Ligand (TRAIL)/CpG Immunotherapy | ||||||||||||||||
L. A. Norian., T. P. Kresowik., H. M. Rosevear., B. R. James., T. R. Rosean., A. J. Lightfoot., T. A. Kucaba., C. Schwarz., C. J. Weydert., M. D. Henry., T. S. Griffith. | |||||||||||||||||
PLos One 7(2):e31085. 2012 | |||||||||||||||||
[13] | Reversal of serologic, immunologic, and histologic dysfunction in mice with systemic lupus erythematosus by long-term serial adipose tissue-derived mesenchymal stem cell transplantation | ||||||||||||||||
E.W. Choi., Il S. Shin., S. Y. Park., J. H. Park., J. S. Kim., E. J. Yoon., S. K. Kang., J. C. Ra., S. H. Hong. | |||||||||||||||||
Arthritis & Rheumatism Vol. 64, Issue 1, pages 243-253, 2012 | |||||||||||||||||
[14] | Serum soluble MD-1 levels increase with disease progression in autoimmune prone MRLlpr/lpr mice | ||||||||||||||||
S. Sasakia., Y. Nagaia., T. Yanagibashia., Y. Watanabea., M. Ikutania., A. Kariyonea., K. Tsuneyamab., Y. Hiraia., K. Takatsua. | |||||||||||||||||
Molecular Immunology Vol.49,Issue4,611-620, 2012 | |||||||||||||||||
[16] | Deamidation of Gliadin Peptides in Lamina Propria: Implications for Celiac Disease | ||||||||||||||||
H. Skovbjerg., D. Anthonsen., E. Knudsen. and H. Sjostrom. | |||||||||||||||||
J of Clinical Immunology Vol.31 ( 6) 1038-1044 , 2011 | |||||||||||||||||
[17] | Transgenic Mice that Overexpress Human IL-15 in Enterocytes Recapitulate Both B and T Cell-Mediated Pathologic Manifestations of Celiac Disease | ||||||||||||||||
S. Yokoyama., K. Takada., M. Hirasawa., L. P. Perera., and T. Hiroi. | |||||||||||||||||
J of Clinical Immunology Vol. 31,(6) , 2011 | |||||||||||||||||
[18] | Coincidence of autoantibody production with the activation of natural killer T cells in a-galactosylceramide-mediated hepatic injury | ||||||||||||||||
H. Matsumoto., T. Kawamura., T. Kobayashi., Y. Kanda., H. Kawamura., T. Abo. | |||||||||||||||||
Immunology Vol. 133, Issue 1, pages 21-28, 2011 | |||||||||||||||||
[19] | Lack of B and T lymphocyte attenuator exacerbates autoimmune disorders and induces Fas-independent liver injury in MRL-lpr/lpr mice | ||||||||||||||||
Y. Oya., N. Watanabe. Y. Kobayashi., T. Owada., M. Oki., K. Ikeda. A. Suto., S. Kagami., K. Hirose., T. Kishimoto., and H. Nakajima. | |||||||||||||||||
Int. Immunol 23 (5): 335-344, 2011 | |||||||||||||||||
[20] | Amelioration of systemic lupus erythematosus by withangulatin A in MRL/lpr mice | ||||||||||||||||
L. Sun., L. Zhou., M. Chen., R. Zhong., J. Liu. | |||||||||||||||||
Journal of Cellular Biochemistry Vol. 112, Issue 9, pages 2376-2382, 2011 | |||||||||||||||||
[21] | Co-appearance of autoantibody-producing B220low B cells with NKT cells in the course of hepatic injury | ||||||||||||||||
Y. Fujii., H. Kawamura., T. Kawamura., Y. Kanda.,H. Matsumoto., T. Kobayashi., T. Yamamoto., T. Aoyama., T. Abo. | |||||||||||||||||
Cellular Immunology Vol.260,Issue2, 105-112, 2010 | |||||||||||||||||
[22] | Identification and characterization of autoantibody-producing B220low B (B-1) cells appearing in malarial infection | ||||||||||||||||
Y. Kanda., H. Kawamura., H. Matsumoto., T. Kobayashi., T. Kawamura., T. Abo. | |||||||||||||||||
Cellular Immunology Vol.263,Issue1, 49-54, 2010 | |||||||||||||||||
[23] | Transplantation of umbilical cord mesenchymal stem cells alleviates lupus nephritis in MRL/lpr mice | ||||||||||||||||
Z. Gu., K. Akiyama., X. Ma., H. Zhang., X. Feng., G. Yao., Y. Hou., L. Lu., GS. Gilkeson., RM. Silver., X. Zeng., S. Shi., L. Sun | |||||||||||||||||
Lupus Vol.19 No.13, 1502-1514, 2010 | |||||||||||||||||
[24] | Augmented TLR9-induced Btk activation in PIR-B-deficient B-1 cells provokes excessive autoantibody production and autoimmunity | ||||||||||||||||
T. Kubo., Y. Uchida., Y. Watanabe., M. Abe., A. Nakamura., M. Ono., S. Akira., and T. Takai. | |||||||||||||||||
J of Experimental Medicine Vol.206 No.9 1971-1982, 2009 | |||||||||||||||||
[25] | Deficiency in EBV-induced gene 3 (EBI3) in MRL/ lpr mice results in pathological alteration of autoimmune glomerulonephritis and sialadenitis | ||||||||||||||||
T. Igawa., H. Nakashima., A. Sadanaga., K. Masutani., K. Miyake., S. Shimizu., A. Takeda., S. Hamano., and H. Yoshida. | |||||||||||||||||
Modern Rheumatology Vol. 19, Number 1, 33-41, 2009 | |||||||||||||||||
[26] | Oncostatin M deficiency leads to thymic hypoplasia, accumulation of apoptotic thymocytes and glomerulonephritis | ||||||||||||||||
E. Esashi1., H. Ito., K. Minehata., S. Saito., Y. Morikawa., A. Miyajima. | |||||||||||||||||
European Journal of Immunology Vol.39,Issue6, 1664-1670, 2009 | |||||||||||||||||
[27] | Amelioration of human lupus-like phenotypes in MRL/lpr mice by overexpression of interleukin 27 receptor a (WSX-1) | ||||||||||||||||
N. Sugiyama., H. Nakashima., T. Yoshimura., A. Sadanaga., S. Shimizu., K. Masutani., T. Igawa., M. Akahoshi., K. Miyake., A. Takeda., A. Yoshimura., S. Hamano., H. Yoshida. | |||||||||||||||||
Ann Rheum Dis 67:1461-1467, 2008 | |||||||||||||||||
[28] | Development of autoantibody responses in NC/Nga mice: its prevention by pulverized konjac glucomannan feeding | ||||||||||||||||
N. Onishi., S. Kawamoto., H. Suzuki., M. Hide., and K. Ono. | |||||||||||||||||
Archives of Dermatological Research Vol.300, 95-99, 2008 | |||||||||||||||||
[29] | CD19 Regulates Skin and Lung Fibrosis via Toll-Like Receptor Signaling in a Model of Bleomycin-Induced Scleroderma | ||||||||||||||||
A. Yoshizaki., Y. Iwata., K. Komura., F. Ogawa., T. Hara., E. Muroi., M. Takenaka., K. Shimizu., M. Hasegawa., M. Fujimoto., T. F. Tedder., and S. Sato. | |||||||||||||||||
Am J Pathol. 172(6): 1650-1663, 2008 | |||||||||||||||||
[30] | Protection against autoimmune nephritis in MyD88-deficient MRL/lpr mice | ||||||||||||||||
A. Sadanaga., H. Nakashima., M. Akahoshi., K. Masutani., K. Miyake., T. Igawa., N. Sugiyama., H. Niiro., M. Harada. | |||||||||||||||||
Arthritis & Rheumatism Vol.56, Issue 5, pages 1618-1628, 2007 | |||||||||||||||||
[31] | Chronic polyarthritis caused by mammalian DNA that escapes from degradation in macrophages. | ||||||||||||||||
Kawane, K., Ohtani, M., Miwa, K., Kizawa, T., Kanbara, Y., Yoshioka, Y., and Yoshikawa, H. | |||||||||||||||||
Nature 443: 998-1002, 2006 | |||||||||||||||||
[32] | Altered cytokine expression in mesenteric lymph nodes in a rat strain (Matsumoto Eosinophilic Shinshu) that spontaneously develops hypereosinophilia | ||||||||||||||||
S. Muto., M. Monnai., Y. Okuhara., M. Murakami., J. Kuroda., T. Ono., K. Matsumoto. | |||||||||||||||||
Immunology Vol. 116, Issue 3, pages 373-380, 2005 | |||||||||||||||||
[33] | Amelioration of autoimmune nephritis by imatinib in MRL/lpr mice | ||||||||||||||||
Sadanaga, A., Nakashima, H., Masutani, K., Miyake, K., shimizu, S., Igawa, T., Sugiyama, N., Niiro, H., Hirakata, H., and Harada, M. | |||||||||||||||||
Arthritis Rheumatism 52: 3987-3996, 2005 | |||||||||||||||||
[34] | Membranous glomerulonephritis development with Th2-type immune deviations in MRL/lpr mice deficient for IL-27 receptor (WSX-1) | ||||||||||||||||
Shimizu, S., Sugiyama, N., Matsutani, K., Sadanaga, A., Miyazaki, Y., Inoue, Y., Akaboshi, M., Katafuchi, R., Hirakata, H., Harada. M., Hamano, S., Nakashima, H., and Yoshida, H. | |||||||||||||||||
J Immunol 175:7185-7192, 2005 | |||||||||||||||||
[35] | Glucose intolerance in young TallyHo mice is induced by leptin-mediated inhibition of insulin. | ||||||||||||||||
Sung, Y.Y., Lee, Y.S., Jung, W.H., Kim, H.Y., Cheon, H.G., Yang, S.D., and Rhee, S.D. | |||||||||||||||||
Biochem Biopys Res Commun. 338: 1779-1787, 2005 | |||||||||||||||||
[36] | Requirement for CD100-CD72 interactions in fine-tubing of B-cell antigen receptor signaling and homeostatic maintenance ofthe B-cell compartment. | ||||||||||||||||
Kumanogoh, A., Shikina, T., Watanabe, C., Takegahara, N., Suzuki, K., Yamamoto, M., Takamatsu, H., Prasad, D.V.R., Mizui, M., Toyohuku, T., Tamaru, M., Watanabe, D., Parnes, J.R., and Kikutani, H. | |||||||||||||||||
International Immuno, 17: 1277-1282, 2005 | |||||||||||||||||
[37] | Chemical induction of HO-1 suppresses lupus nephritis by reducing local iNOS expression and synthesis of anti-dsDNA antibody. | ||||||||||||||||
Takeda, Y., Takeno, M., Iwasaki, M., Kobayashi, H., Kirino, Y., Ueda, A., Nagahama, K., Aoki, I., and Ishigatsubo, Y | |||||||||||||||||
Clin Exp Immunol. 138:237-244, 2004 | |||||||||||||||||
[38] | The point mutation of tyrosine 759 of the IL-6 family cytokine receptor gp130 synergizes with HTLV-1 pX in promoting rheumatoid arthritis-like arthritis. | ||||||||||||||||
Ishihara, K., Sawa, S., Ikushima, H., Hirota, S., Atsumi, T., Kamimura, D., Park, S.J., Murakami, M., Kitanuma, Y., Iwakura, Y., and Hirano, T. | |||||||||||||||||
International Immunol. 16: 455-465, 2004 | |||||||||||||||||
[39] | Inadequate induction of suppressor of cytokine signaling-1 causes systemic autoimmune disease | ||||||||||||||||
Fujimoto, M., Tsutsui, H., Xinshou, O., Tokumoto, M., Watanabe, D., Shima, Y., Yoshimoto, T., Hirakata, H., Kawase, I., Nakanishi, K., Kishimoto, T., and Naka, T. | |||||||||||||||||
International Immunol. 16: 303-314, 2004 | |||||||||||||||||
[40] | Suppressor of cytokine signaling-1 is essential for suppressing dendritic cell activation and systemic autoimmunity. | ||||||||||||||||
Hanada, T., Yoshida, H., Kato, S., Tanaka, K., Matsutani, K., Tsukada, J., Nomura, Y., Mimata, H., Kubo, M., and Yoshimura, A. | |||||||||||||||||
[41] | Association of Cathepsin E Deficiency with Development of Atopic Dermatitis | ||||||||||||||||
Tsukuba et al. | |||||||||||||||||
J Biochem (Tokyo). 134: 893-902, 2003 | |||||||||||||||||
[42] | Fc RIIB deficiency with Fas mutation is sufficient for the development of systemic autoimmune disease. | ||||||||||||||||
Yajima, K., Nakamura, A., Sugahara, A., and Takai, T. | |||||||||||||||||
Eur J Immunol, 33:(4) 1020-1029, 2003 | |||||||||||||||||
[43] | A Point Mutation of Tyr-759 in Interleukin 6 Family Cytokine Receptor Subunit gp130 Causes Autoimmune Arthritis | ||||||||||||||||
T. Atsumi., K. Ishihara., D. Kamimura., H. Ikushima., T. Ohtani., S. Hirota., H. Kobayashi., S. Park., Y. Saeki., Y. Kitamura. and T. Hirano | |||||||||||||||||
J Exp Med, 196, Number 7, 979-990, 2002 | |||||||||||||||||
[44] | A novel assay kits for autoantibodies rate on spontaneous autoimmune model mice. | ||||||||||||||||
Kikukawa, T, Kojima, M., and Abe, C. | |||||||||||||||||
Jap J Inflammation 20: 697-701, 2000 | |||||||||||||||||
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 297-91801 | LBIS® Mouse Anti-dsDNA ELISA Kit LBIS® 抗dsDNA-小鼠ELISA试剂盒 |
96 tests | - | - |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |