高灵敏度脂滴长时间成像荧光染料
LipiDye Ⅱ
LipiDye II 是一款可用于长时间活细胞成像的高灵敏度优质脂滴染料试剂。此外,它还具有脂滴特异性高、毒性低和光稳定性高的优点。适用于以天数为单位的长时间观察、脂滴融合和分解过程的活细胞成像以及使用超高分辨率显微镜的超微小脂滴可视化。
LipiDye II 是LipiDye(#FDV-0010)的改良版试剂,关于LipiDye 的产品信息,请点击此处查看。
※ 本产品基于名古屋大学 变革生命分子研究所 山口茂弘教授、多喜正泰特任准教授的研究结果,由funakoshi株式会社进行商品化并销售。
※ 本产品仅供研究用,请勿用于研究以外用途。
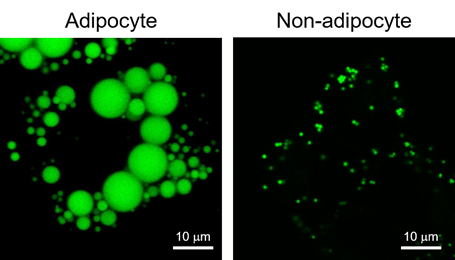
使用LipiDye II染色脂肪细胞和非脂肪细胞的案例
◆关于脂滴(Lipid droplet)和LipiDye
脂滴(Lipid droplet)是在脂肪细胞(Adipocyte)中发现的大型中性脂肪的结块,主要成分是甘油三酯(Triglyceride)和甾醇酯(Sterol Ester)的单分子层结构体(图1)。脂滴被认为是储存细胞内中性脂质的细胞器,并且有较多肥胖和疾病相关的报道。最近,除了脂肪细胞,还在肝细胞、平滑肌细胞、神经胶质细胞等各种细胞中发现了脂滴。这些发现明确了其不仅仅是作为中性脂质的储存场所,还有抑制代谢和调节基因表达等各种功能。对各种细胞中的脂滴进行观察发现,非脂肪细胞的脂滴在1 μm以下,与脂肪细胞中的10~100 μm的脂滴相比较小(图2)。因此,可以利用成像来检测活细胞中非脂肪细胞的微小脂滴的试剂备受期待,但目前Nile Red等现有试剂会观察到脂滴以外的染色试剂(信噪比低),不适用于活细胞成像,观察微小脂滴仅限于电子显微镜观察。
而LipiDye 是一款可以显示高S/N比率的脂滴染色试剂,虽然检测1 μm以下的小脂滴的效果优异,但从光稳定性的观点来看,长时间活细胞成像的效果不佳。而LipiDye II 是名古屋大学 变革生命分子研究所(ITbM)的山口教授、多喜特任准教授为了解决上述问题而研发的新型脂滴检测试剂(参考文献中的名称为LAQ1),光稳定性非常高,毒性低,适合用于长时间稳定的活细胞成像。
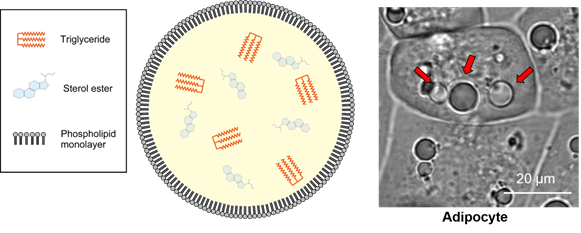
图1:脂滴的模式图及脂肪细胞(adipocyte)中可见的大型脂滴
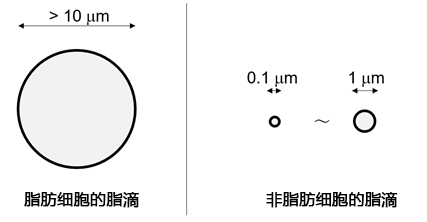
图2:不同细胞类型中脂滴的成像图例
◆特点
● 不仅可以选择性浓缩脂滴,还会响应疏水性环境而发出荧光,因此可以抑制细胞质等的部分发光,对脂滴有着高信噪比(S/N比)
● 可检测非脂肪细胞中的小型脂滴(小于1 μm)
● 光稳定性高,长时间活细胞成像效果优异
● 由于不会褪色,可用于脂滴分解过程中的荧光观察
● 在推荐的使用浓度(0.1~1 μM)中几乎不显示细胞毒性。在已添加试剂的状态下,脂肪细胞分化过程的观察记录最长达8天
● 活细胞、固定细胞都可使用。也适用于活细胞染色后再固定处理的情况
● 也适用于STED超高分辨率显微镜。可观察到约200 nm(半峰全宽)的脂滴
◆关于荧光波长(激发/发射波长)
激发/发射波长:400~500 nm/490~600 nm
※ 虽然最大吸收为410~420 nm,但也可用450~500 nm范围的光源激发。详情请参考下方的激发/发射光谱数据。
※ 可用800 nm激光进行双光子激发。详情请参考下方利用双光子显微镜观察小胶质细胞。
※ 可进行多重染色,但需要注意波长的选择。请使用激发光在500 nm以上的染料。若使用在450 nm以下的范围内激发的普通蓝色荧光染料,可能
※ 会同时激发本试剂。
■ 光源示例
激发光 | 405 nm、 445 nm、 458 nm、 473 nm、 488 nm*等 对观察条件进行验证。 |
光源+滤光片 | 可利用一般的FITC或GFP滤片。 |
STED超高分辨率显微镜 | 推荐激发光:473 nm激光,STED光:660 nm激光 |
◆LipiDye与其他试剂相比的优点
试剂名称 | 颜色 | 激发光的波长 | 活细胞的染色 | 固定细胞的染色 | 光稳定性 | 延时成像 | 多重染色 | S/N比率 |
LipiDye II | 绿色荧光 | 400~500 nm | 可 | 可 | 非常高 | 超长时间 可 | 可(注意波长的选择) | 高 |
LipiDye | 绿色荧光 | 400~470 nm | 可 | 可 | 高 | 短时间 可 | 可(注意波长的选择) | 高 |
Nile Red | 红色荧光 | ~510 nm | 可 | 可 | 低 | 不适合 | 不适合 | 低 |
荧光染料B | 绿色荧光 | ~480 nm | 可 | 可 | 低 | 可 | 可 | 中 |
脂滴染色试剂A | 红色和绿色荧光 | —— | 不可 | 可 | 未知 | 不可 | 可 | 高 |
Oil Red O | 红色染料 | —— | 不可 | 可 | —— | 不可 | —— | 低 |
◆参考文献
"Fused Thiophene-S,S-dioxide-Based Super-Photostable Fluorescent Marker for Lipid Droplets."
Taki, M., et al., ACS Mater. Lett., 3(1), 42~49 (2021)
◆参考数据
激发/发射光谱
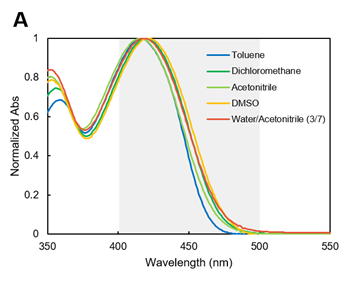
LipiDye II是溶剂环境响应型荧光染料(Solvatochromic dye),会根据周围的分子极性改变荧光波长。吸收光谱几乎不受溶剂的影响,可观察到在380~500 nm的吸收(图A)。
● 推荐激发光:405 nm、445 nm、458 nm、473 nm激光
● 可使用的激发光:488 nm激光(由于荧光强度弱,建议根据不同的实验对使用浓度等进行验证。)
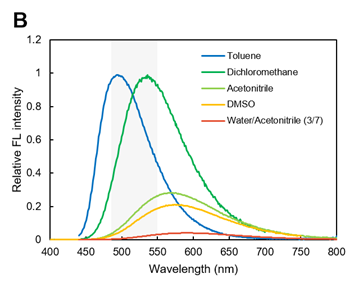
另外,荧光光谱依赖于溶剂极性,在甲苯和二氯甲烷等疏水性环境下会显示强烈的蓝~绿色荧光,但在乙腈、DMSO和水溶液等高极性环境下,极性越大,最大荧光就会转移至长波长一侧,对荧光强度的抑制就越明显(图B)。根据这个特性,可观察到脂滴在疏水性环境下的特异性绿色荧光。
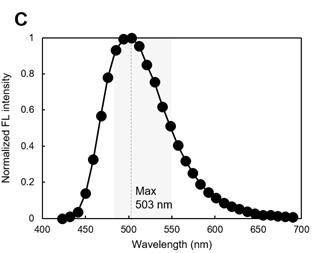
用LipiDye II对细胞染色,用显微镜光谱扫描脂滴部分,评估脂滴的荧光,约在500 nm附近可观察到最大的荧光光谱(图C)。
※ 图A~图C的灰色阴影区域为推荐激发/荧光波长。
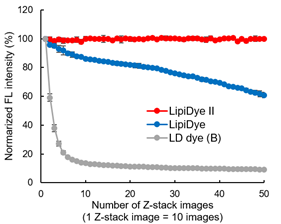
光稳定性
用4%多聚甲醛固定处理3T3-L1脂肪细胞,再分别用新产品LipiDye II、旧款产品LipiDye 和传统的荧光染料B染色,之后使用共聚焦激光显微镜反复进行Z-stack成像(激发473 nm/荧光:490~540 nm),观察荧光强度的变化。在Z-stack成像中,每拍摄一次可获取10张2 μm的图像。传统染料B经过约5次的Z-stack成像后衰减明显,而相比之下,旧款产品LipiDye虽然有耐光性,但也观察到了缓慢的衰减,在经过50次的Z-stack成像后荧光衰减至60%左右。
而在本试剂LipiDye II中,即使经过50次(共计500次的光照射),其荧光强度也几乎不发生变化。显示了LipiDye II具有非常高的光稳定性,适用于长时间的延时成像(包括Z-stack成像)。
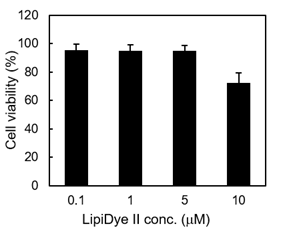
细胞毒性
使用不同浓度的LipiDye II 处理 3T3-L1脂肪细胞,然后使用MTT Assay评估24 h后的细胞活性。本试剂的推荐使用浓度为0.1~1 μM,但至少在5 μM内未观察到细胞毒性。在10 μM以上才观察到细胞毒性。
活细胞和固定细胞染色
用LipiDye II对活细胞状态下的3T3-L1脂肪细胞染色,然后在活细胞中进行荧光观察(左图)。之后,用4%多聚甲醛固定细胞,清洗后在固定状态下再次进行荧光观察(右图)。固定前后几乎未观察到荧光信号的变化。表明了本试剂除了可用于活细胞染色,也可兼容固定细胞的免疫染色。
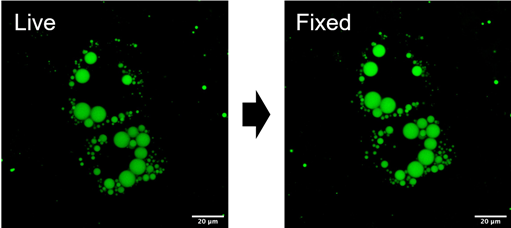
LipiDye®染色的活细胞和经PFA固定后的荧光强度的对比
◆应用数据
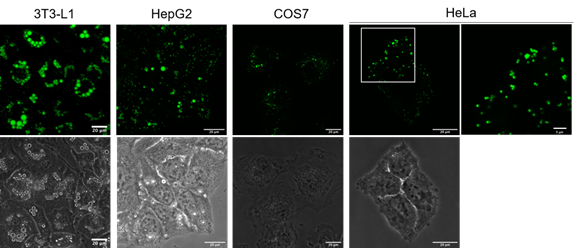
在各种细胞中的染色
用LipiDye II(1 μm)分别染色3T3-L1、HepG2、COS-7、HeLa细胞,在共聚焦激光显微镜下观察绿色荧光(激发473 nm/荧光490~540 nm)(比例尺:20 μm)。在HepG2中,为使脂滴形成,用脂肪酸处理了1天。在HeLa细胞中可清晰地观察到1 μm以下的小脂滴(参考Hela细胞放大图像(右侧),比例尺:5 μm)。
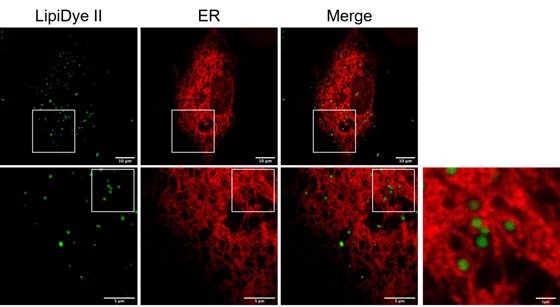
内质网(ER)标记及其多色成像
用LipiDye II(1 μm)对表达内质网(ER)驻留红色荧光蛋白(ER-mKO1)的COS-7细胞进行染色,使用共聚焦激光显微镜进行荧光观察(LipiDye II:激发473 nm/荧光490~540 nm,ER-mKO1:激发559 nm/荧光570~620 nm)。可以观察到COS-7细胞内部的小脂滴(<1 μm),并且大部分驻留于内质网结构的内侧(参考右侧的放大图,比例尺:1 μm)。该结果表明内质网中存在脂滴的生物合成。
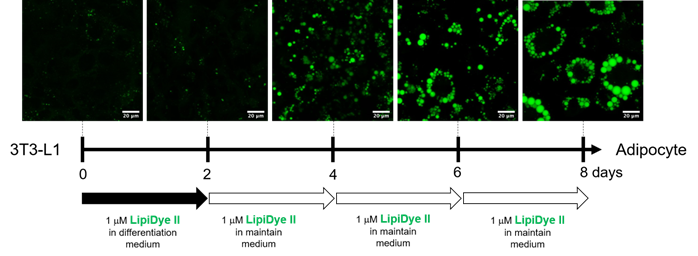
长时间观察脂肪细胞的分化过程
用LipiDye II在共聚焦激光显微镜下观察活细胞中诱导前脂肪细胞3T3-L1分化为脂肪细胞时,成熟脂滴的状态8天(激发473 nm/荧光490~540 nm)。前2天在含LipiDye II的分化培养基中培养3T3-L1细胞,之后每隔两天更换至含LipiDye II(1 μm)的维持培养基中,荧光观察共计8天。即使用LipiDye II进行长时间的处理,也没有细胞毒性和对脂肪细胞分化产生影响,可以观察到脂滴成熟的过程。
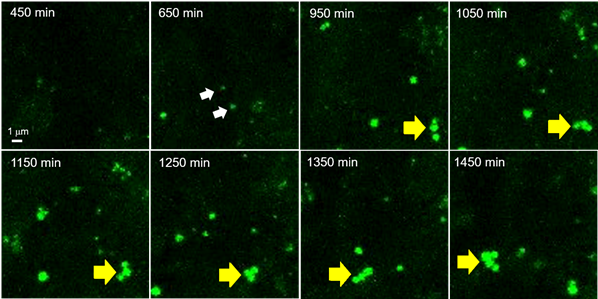
活细胞成像中新生脂滴的动态行为分析
利用长时间延时成像(Z-stack成像),观察在诱导前脂肪细胞3T3-L1分化为脂肪细胞时新生脂滴的动态行为约24 h(共聚焦激光显微镜:激发473 nm/荧光490~540 nm,每10 min拍摄一次,Z-stack 20张/次)。向预先已经用LipiDye II染色的前脂肪细胞中添加分化培养基(含有LipiDye II),然后立即开始延时成像。分化诱导后约10 h,开始看到小脂滴的出现(650 min,白色箭头),可以观察到各脂滴在相互作用的同时,不断成长的状态(950~1450 min,黄色箭头)。
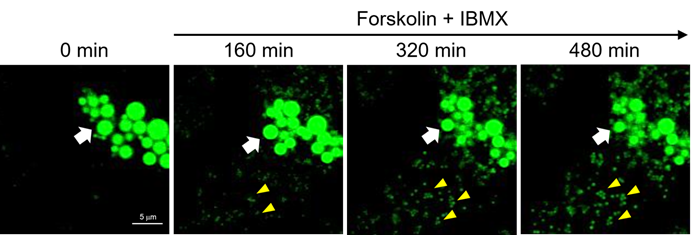
观察脂滴分解·新生过程随着时间的变化
向分化诱导的3T3-L1细胞中添加腺苷酸环化酶激活剂Forskolin(10 μM)和磷酸二酯酶抑制剂IBMX(100 nM),观察在使用了LipiDye II的延时成像(Z-stack)中脂滴随着三酰基甘油的分解而缩小的过程(共聚焦激光显微镜:激发473 nm/荧光490~540 nm,800 min,每4 min拍摄一次,Z-stack 15张/次)。从图中可以看到原本的大脂滴(请参见白色箭头)随着时间的推移逐渐变小。另外,可以看到随着时间的推移又产生了许多小脂滴(黄色三角形)。
结果表明,LipiDye II具有非常高的光稳定性,无需担心褪色;并有着高信噪比,可以观察到微小的新生脂滴,因此可以定量观察脂滴的增减。
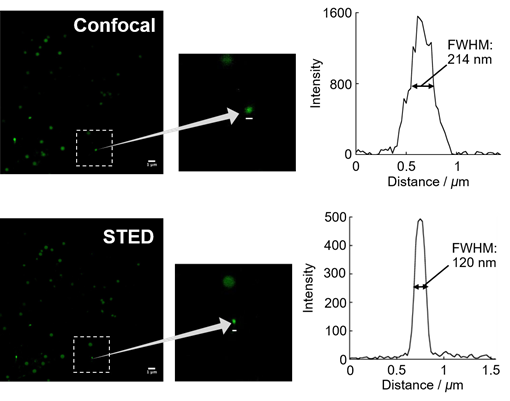
利用STED超高分辨率显微镜可视化微小脂滴
用LipiDye II(1 μm)染色Hela细胞,使用激光共聚焦显微镜(Confocal)(激发473 nm/荧光490~540 nm)和STED超高分辨率显微镜(激发473 nm + STED 660 nm/荧光500~640 nm)对微小脂滴进行观察。STED观察图像显示的是经过反卷积处理的数据。从图中可以发现在共聚焦激光显微镜下较为模糊的微小脂滴,在STED显微镜中非常清晰,半峰全宽(FWHM)约为120 nm。
※ 关于STED显微镜的观察条件及分析方法,请见参考文献。
利用双光子显微镜观察小胶质细胞
向大鼠原代培养小胶质细胞中添加LipiDye II(1 μm),染色过夜后,用4%PFA固定,然后在双光子显微镜下进行观察。可见LipiDye II使用双光子激发法也可以激发,可以检测原代培养小胶质细胞中尺寸各异的脂滴。
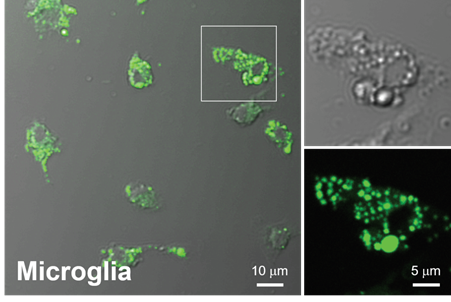
(数据提供:Dr. Hyun Beom Choi以及 Dr. Brian MacVicar, The University of British Columbia)
第一代产品点击此处查看
※ 本页面产品仅供研究用,研究以外不可使用。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| FDV-0027 | LipiDye II ( Live Imaging) LipiDye II(脂滴活细胞成像试剂) |
0.1 mg | - | - |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |